题目内容
Q、W、X、Y、Z元素为前四周期元素,且原子序数依次增大,Q元素的阳离子核外无电子,W元素原子的最外层电子数是次外层电子数的2倍,Y是地壳中含量最多的元素,Z的价电子排布式为3d104s1.
(1)W位于元素周期表第 周期第 族,W的第一电离能 (填“大于”或“小于”)X的第一电离能.
(2)XQ3分子的分子式为 ,所含化学键类型为 共价键(填“极性”或“非极性”).
(3)Z的基态原子核外电子排布式是 ,Z的单质与X的最高价氧化物对应的水化物的稀溶液反应的化学方程式 .
(1)W位于元素周期表第
(2)XQ3分子的分子式为
(3)Z的基态原子核外电子排布式是
考点:位置结构性质的相互关系应用
专题:
分析:Q、W、X、Y、Z元素为前四周期元素,且原子序数依次增大,Q元素的阳离子核外无电子,故Q为氢,W元素原子的最外层电子数是次外层电子数的2倍,故W是碳,Y是地壳中含量最多的元素,故Y是氧,W、X、Y原子序数依次增大,故X是氮,Z的价电子排布式为3d104s1,故Z是铜,据此解答各小题即可.
解答:
解:Q、W、X、Y、Z元素为前四周期元素,且原子序数依次增大,Q元素的阳离子核外无电子,故Q为氢,W元素原子的最外层电子数是次外层电子数的2倍,故W是碳,Y是地壳中含量最多的元素,故Y是氧,W、X、Y原子序数依次增大,故X是氮,Z的价电子排布式为3d104s1,故Z是铜,
综上所述可知:Q为氢,W为碳,X为氮,Y为氧,Z为铜,
(1)W为碳,C位于元素周期表第二周期第ⅣA族,非金属性越强,其第一电离能越大,故C的第一电离能<N的第一电离能,故答案为:二;ⅣA;小于;
(2)XQ3为NH3,含有极性共价键,故答案为:NH3;极性;
(3)Z为铜,Cu的基态原子核外电子排布式是:[Ar]3d104s1,Cu与N的最高价氧化物对应的水化物(即HNO3)的稀溶液反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
综上所述可知:Q为氢,W为碳,X为氮,Y为氧,Z为铜,
(1)W为碳,C位于元素周期表第二周期第ⅣA族,非金属性越强,其第一电离能越大,故C的第一电离能<N的第一电离能,故答案为:二;ⅣA;小于;
(2)XQ3为NH3,含有极性共价键,故答案为:NH3;极性;
(3)Z为铜,Cu的基态原子核外电子排布式是:[Ar]3d104s1,Cu与N的最高价氧化物对应的水化物(即HNO3)的稀溶液反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
点评:本题考查结构性质位置关系应用,涉及核外价电子排布、共价键的判断、化学反应方程式的书写、电负性电离能的比较等,推断元素是解题关键,难度中等.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
有机物A结构如图所示,下列说法正确的是( )
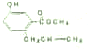

| A、A在碱性条件下不能发生水解反应 |
| B、1molA能和4mol氢气发生加成反应 |
| C、和溴水反应时,1molA能消耗1molBr2 |
| D、A不能使酸性高锰酸钾溶液褪色 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、0.1mol?L-1的NaF溶液中所含F-的数目小于0.1NA |
| B、标准情况下,2.24L乙醇中含有的C-H键数目为0.5NA |
| C、0.1mol Na完全被氧化生成Na2O2,转移电子的数目为NA |
| D、0.1mol O2中含氧原子数目为0.2NA |
室温下0.1mol/L的NH4CN溶液的pH等于9.32.下列说法错误的是( )
| A、上述溶液能使甲基橙试剂变黄色,石蕊试液变蓝 |
| B、室温下,HCN是比NH3?H2O更弱的电解质 |
| C、上述溶液中NH4+的水解程度大于CN-的水解程度 |
| D、室温下,0.1mol/LNaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度 |

 现有部分前四周期7种元素,原子序数依次增大,它们的性质或原子结构如下表:
现有部分前四周期7种元素,原子序数依次增大,它们的性质或原子结构如下表: