题目内容
17.胡椒酚是植物挥发油的成分之一,它的结构简式为: ,下列叙述中正确的是( )
,下列叙述中正确的是( )| A. | 1mol胡椒酚最多可与5molH2发生反应 | |
| B. | 1mol胡椒酚最多可与4mol溴发生反应 | |
| C. | 胡椒酚中所有原子可以共平面 | |
| D. | 胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |
分析 分子中含有酚羟基,可发生取代、氧化和颜色反应,含有碳碳双键,可发生加成、加聚和氧化反应,以此解答该题.
解答 解:A.分子中含有苯环和1个碳碳双键,则1mol胡椒酚最多可与4mol氢气发生反应,故A错误;
B.分子中含有1个酚羟基,有2个邻位氢原子可被取代,且碳碳双键可与溴发生加成反应,则1mol胡椒酚最多可与3mol溴发生反应,故B错误;
C.结构简式中含有亚甲基,不可能共面,故C错误;
D.胡椒酚中含有烃基碳原子数多于苯环的碳原子数,为憎水基,则胡椒粉在水中的溶解度小于苯酚在水中的溶解度,故D正确.
故选D.
点评 本题考查有机物的结构和性质,为高考常见题型和高频考查,侧重于学生的分析能力的考查,注意把握有机物的结合特点和官能团的性质,为解答该题的关键,难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
7.一定温度下,反应O2(g)+2H2(g)?2H2O(g)的反应热和化学平衡常数分别为△H和K,则相同温度下反应4H2O(g)?2O2(g)+4H2(g)的反应热和化学平衡常数为( )
| A. | 2△H和2K | B. | -2△H和K2 | C. | 2△H和-2K | D. | -2△H和K-2 |
8.下列反应中,属于加成反应的是( )
| A. | 苯和液溴在FeBr3催化作用下生成溴苯 | |
| B. | 丙烯和氯气在一定条件下反应生成ClCH2CH=CH2的反应 | |
| C. | 乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯与HCl气体反应生成一氯乙烷 |
5.下列说法正确的是( )
| A. | 煤、石油是不可再生能源,天然气是可再生能源 | |
| B. | 在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 | |
| C. | 热值指在一定条件下,1mol的物质完全燃烧所放出的热量 | |
| D. | 若化学过程中断开化学键放出的能量大于形成化学键所吸收的能量,则反应放热 |
12.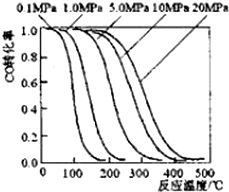 甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )
甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )
 甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )
甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )| A. | 旧法生产中,由图知CO与H2合成甲醇的反应属于放热反应 | |
| B. | 旧法生产中,选择合适的催化剂时,可推测高压法合成比低压法合成更有发展优势 | |
| C. | 新法与旧法相比,反应更困难 | |
| D. | 新法生产中,需控制V(CH4)/V(O2)=9:1,目的是提高空气中氧气的转化率 |
2.乙硼烷(B2H6)是一种潜在的高能燃料,工业上可用反应:B2O3+2Al+3H2$\frac{\underline{\;AlCl_{3}\;}}{高压}$Al2O3+B2H6制取,下列有关说法正确的是( )
| A. | 反应中氢气作还原剂,铝作氧化剂 | B. | B2H6充分燃烧生成B2O3和H2O | ||
| C. | B2H6中存在共价键和离子键 | D. | 每生成1molB2H6转移3mol电子 |
9.两个体积相同的容器,一个盛CO2,另一个盛N2和O2,在同温同压下,两容器内的气体一定具有相同的( )
| A. | 原子总数 | B. | 摩尔质量 | C. | 分子总数 | D. | 质量 |
7. 某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:
某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:
(1)为准确读取量气管的读数,除视线应与量气管凹液面最低处向平,还应注意使气体冷却至室温,量气管中的液面与漏斗中的液面要相平齐若考虑分液漏斗滴入烧瓶中液体的体积(假设其它操作都正确),则测得气体的体积将无影响(填“偏大”、“偏小”或“无影响”).
(2)若在烧瓶中放入生铁,用此装置验证生铁在潮湿空气中发生吸氧腐蚀.
①通过分液漏斗向烧瓶中加入的试剂可选用下列ac(填序号)
a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中发生吸氧腐蚀的现象是量气管液面会下降.
(3)若烧瓶中放入粗铜片(杂质不参与反应),分液漏斗内放稀硝酸,通过收集并测量NO气体的体积来探究粗铜样品的纯度.你认为此方法是否可行不可行,铜与稀硝酸反应生成的NO会与空气的氧气反应生成二氧化氮,进而与水生成硝酸,会影响NO的体积的测定(填“可行”或“不可行”,若填“不可行”请说明原因).
(4)为探究MnO2在H2O2制取O2过程中的作用,将等量的H2O2加入烧瓶中,分别进行2次实验(气体体积在同一状况下测定):
若实验1中MnO2的作用是催化剂,则实验2中发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑、H2O2+MnO2+H2SO4=2H2O+O2↑+MnSO4.
(5)若烧瓶中放入镁铝合金,分液漏斗内放NaOH溶液,分别进行四次实验,测得以下数据(气体体积均已换算成标准状况):
则镁铝合金中镁的质量分数为73%.
 某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:
某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:(1)为准确读取量气管的读数,除视线应与量气管凹液面最低处向平,还应注意使气体冷却至室温,量气管中的液面与漏斗中的液面要相平齐若考虑分液漏斗滴入烧瓶中液体的体积(假设其它操作都正确),则测得气体的体积将无影响(填“偏大”、“偏小”或“无影响”).
(2)若在烧瓶中放入生铁,用此装置验证生铁在潮湿空气中发生吸氧腐蚀.
①通过分液漏斗向烧瓶中加入的试剂可选用下列ac(填序号)
a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中发生吸氧腐蚀的现象是量气管液面会下降.
(3)若烧瓶中放入粗铜片(杂质不参与反应),分液漏斗内放稀硝酸,通过收集并测量NO气体的体积来探究粗铜样品的纯度.你认为此方法是否可行不可行,铜与稀硝酸反应生成的NO会与空气的氧气反应生成二氧化氮,进而与水生成硝酸,会影响NO的体积的测定(填“可行”或“不可行”,若填“不可行”请说明原因).
(4)为探究MnO2在H2O2制取O2过程中的作用,将等量的H2O2加入烧瓶中,分别进行2次实验(气体体积在同一状况下测定):
| 序号 | 烧瓶中的物质 | 测得气体体积 |
| 实验1 | 20mL H2O2,足量MnO2 | V1 |
| 实验2 | 20mL H2O2,足量MnO2和稀硫酸 | V1<V2<2V1 |
(5)若烧瓶中放入镁铝合金,分液漏斗内放NaOH溶液,分别进行四次实验,测得以下数据(气体体积均已换算成标准状况):
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| Ⅰ | 1.0g | 10.00mL | 346.30mL |
| Ⅱ | 1.0g | 10.00mL | 335.50mL |
| Ⅲ | 1.0 g | 10.00mL | 346.00mL |
| Ⅳ | 1.0g | 10.00mL | 345.70mL |
 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中的信息,填写空格.