题目内容
4.填写下列空白:(1)CO2的相对分子质量是44,CO2的摩尔质量是44g/mol,1molCO2的质量是44g.
(2)标准状况下,1.7gNH3的物质的量是0.1mol,体积是2.24L,它与标况下的3.36L H2S含有相同数目的氢原子
(3)3mol H2O中含有的氧原子数与1.5mol CO2中含有的氧原子数相等.
(4)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为17:16.
(5)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为4:3.
分析 (1)CO2的相对分子质量是44,并结合m=nM计算;
(2)根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$,结合摩尔质量与相对分子质量的关系以及分子的组成原子的原子结构计算;
(3)CO2中含有的氧原子物质的量为CO2的2倍,H2O含有的氧原子物质的量与H2O的物质的量相等,二者含有氧原子个数相同,则含有氧原子物质的量相等,据此计算;
(4)物质的量相等时,质量之比等于摩尔质量之比;
(5)NH3与CH4中氢原子个数之比为3:4.
解答 解:(1)CO2的相对分子质量是44,CO2的摩尔质量是44g/mol,m=nM=1mol×44g/mol=44g,故答案为:44;44g/mol;44g;
(2)1.7g NH3的物质的量为n=$\frac{m}{M}$=$\frac{1.7g}{17g/mol}$=0.1mol;标准状况下的体积为V=nVm=0.1mol×22.4L/mol=2.24L;含有氢原子的物质的量为0.3mol,与氨气所含H原子数相同的H2S的物质的量为0.15mol,则其体积为0.15mol×22.4L/mol=3.36L,
故答案为:0.1mol;2.24L;3.36;
(3)每个CO2分子含有2个O原子,故CO2中含有的氧原子物质的量为CO2的2倍,1.5molCO2含有氧原子物质的量=1.5mol×2=3mol,H2O含有的氧原子个数与1.5mol CO2中含有的氧原子数相同,则含有氧原子物质的量相等,H2O含有的氧原子物质的量与H2O的物质的量相等,故水的物质的量为3mol,
故答案为:3;
(4)物质的量相等时,质量之比等于摩尔质量之比,故等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比等于17:16,故答案为:17:16;
(5)NH3与CH4中氢原子个数之比为3:4,故要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为4:3,故答案为:4:3.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,注意有关计算公式的运用和物质的结构和组成.

 同步奥数系列答案
同步奥数系列答案| A. | 混合气体中二氧化碳与一氧化碳的物质的量各为1:1 | |
| B. | 混合气体缓慢通过足量的氢氧化钠溶液后,剩余的气体是一氧化碳 | |
| C. | 混合气体的平均相对分子质量为36g•mol-1 | |
| D. | 根据题给条件无法计算混合气体在标准状况下的密度 |
| A | B |
| ②使溴的四氯化碳溶液褪色; ②比例模型为: 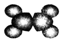 ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成; ②球棍模型为: 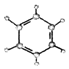 |
(1)A的名称是:乙烯
(2)写出在一定条件下,A生成高分子化合物的化学反应方程式
 .
.(3)B的名称为:苯.B与乙苯互为同系物.其中乙苯的同分异构体还3 种.写出其中一种的物质名称邻二甲苯(或间二甲苯或对二甲苯).
| A. | 在常温常压下,11.2 L N2含有分子数为0.5 NA | |
| B. | 在常温常压下,22.4 L Ne含有分子数为NA | |
| C. | 71 g Cl2所含原子数为2 NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含原子数相同 |
| A. | 某溶液$\stackrel{+石蕊}{→}$溶液呈红色:原溶液是酸溶液 | |
| B. | 某溶液$\stackrel{+盐酸酸化}{→}$无明显现象$\stackrel{+BaCl_{2}溶液}{→}$有白色沉淀:原溶液中含SO42- | |
| C. | 某溶液$\stackrel{+酚酞}{→}$溶液呈红色:原溶液是碱溶液 | |
| D. | 某溶液$\stackrel{+稀硫酸}{→}$生成无色无味气体,说明原溶液中有CO32- |
| A. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| C. | 先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 | |
| D. | 萃取,分液前不需对分液漏斗检漏 |
| A. | 某溶液中水电离出的c(H+)=10-13,则该溶液的pH一定为13 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 | |
| C. | pH相同的氨水与盐酸等体积混合,所得溶液pH<7 | |
| D. | pH=7的CH3COOH与CH3COONa混合溶液中,c(Na+)=c(CH3COO-) |
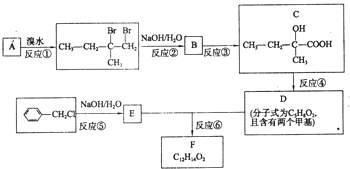 分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线.
分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线.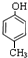 .
.