题目内容
1.下列离子方程式错误的是( )| A. | Na与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液腐蚀铜印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| C. | 明矾溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 盛放NaOH溶液的试剂瓶不能使用玻璃塞:SiO2+2OH-═SiO32-+H2O |
分析 A.电子、电荷守恒;
B.电子、电荷不守恒;
C.反应生成偏铝酸钠和水;
D.反应生成硅酸钠和水.
解答 解:A.Na与水反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故A正确;
B.FeCl3溶液腐蚀铜印刷电路板的离子反应为2Fe3++Cu═2Fe2++Cu2+,故B错误;
C.明矾溶液中加入过量NaOH溶液的离子反应为Al3++4OH-═AlO2-+2H2O,故C正确;
D.盛放NaOH溶液的试剂瓶不能使用玻璃塞的离子反应为SiO2+2OH-═SiO32-+H2O,故D正确;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
12.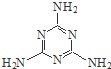 密胺是重要的工业原料,结构简式如图.工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺.若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )
密胺是重要的工业原料,结构简式如图.工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺.若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )
 密胺是重要的工业原料,结构简式如图.工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺.若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )
密胺是重要的工业原料,结构简式如图.工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺.若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )| A. | 17:44 | B. | 22:17 | C. | 17:22 | D. | 2:1 |
16.下列各组元素,按原子半径依次减小,元素第一电离能逐渐增大的顺序排列的是( )
| A. | K Na Li | B. | Al Mg Na | C. | N O C | D. | Cl S P |
6.下列说法正确的是( )
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有需要加热的化学反应都是吸热反应 | |
| C. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 开发利用可燃冰是缓解能源紧缺的唯一途径 |
13.干电池原理如图所示,电池总反应为Zn+2NH4+═Zn2++2NH3↑+H2↑.下列说法正确的是( )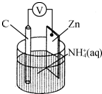

| A. | 碳电极上发生还原反应 | |
| B. | Zn极上发生还原反应 | |
| C. | 常见锌锰干电池为二次电池 | |
| D. | 负极上发生的反应为2NH4++2e-═2NH3↑+H2↑ |

 ,D分子中含氧官能团的名称为羧基,反应B→C的反应类型为取代反应.
,D分子中含氧官能团的名称为羧基,反应B→C的反应类型为取代反应.  ),下列有关G的叙述正确的是B.(填选项)
),下列有关G的叙述正确的是B.(填选项)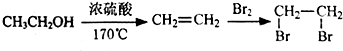
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.