题目内容
10.如图是部分短周期元素的化合价与原子序数的关系图,下列说法正确的是( )
| A. | 原子半径:R>W>Z>Y>X | |
| B. | 氧化物对应水化物的酸性:R>W | |
| C. | 气态氢化物的稳定性:W>X | |
| D. | Y、Z、W最高价氧化物对应水化物两两之间均能相互反应 |
分析 短周期元素,由表中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,为Al元素,W的化合价为+6、-2价,故W为S元素,R的最高正价为+7价,应为Cl元素,以此解答该题.
解答 解:由以上分析可知X为O元素,Y为Na元素,Z为Al元素,W为S元素,R为Cl元素,
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径应为Y>Z>W>R>X,故A错误;
B.如不是最高价氧化物,则对应的水化物的酸性强弱无法比较,故B错误;
C.非金属性X>W,氢化物的稳定性:W<X,故C错误;
D.Y、Z、W最高价氧化物对应水化物分别为NaOH、氢氧化铝、硫酸,氢氧化铝具有两性,则两两之间均能相互反应,故D正确;
故选D.
点评 本题考查原子结构与元素周期律的关系,为高频考点,侧重考查学生的分析能力,题目难度中等,答题时注意根据化合价结合原子序数进行推断,首先审题中要抓住“短周期元素”几个字.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
20.取四个干燥的烧瓶,分别装入标准状况下的干燥氨气、含有二分之一体积空气的氯化氢、二氧化氮和氧气(体积比为4:1)的混合气体、二氧化氮和氧气(体积比为4:3)的混合气体;然后分别做溶解于水的喷泉实验.实验结束后四个烧瓶中所得溶液的物质的量浓度之比为( )
| A. | 2:1:2:2 | B. | 5:5:5:4 | C. | 5:5:4:4 | D. | 7:7:4:3 |
1.下列有关物质的用途不正确的是( )
| A. | 液氨可用作制冷剂 | B. | SO2广泛用于食品漂白 | ||
| C. | 铁制容器可用于存储浓硝酸 | D. | 浓硫酸不能用来干燥氨气 |
18.生活中有机化合物随处可见.以下生活中提到物质的主要成分不属于高分子化合物的是( )
| A. | 蚕食被中含有的蚕丝 | B. | 大豆油、猪油中含有的油脂 | ||
| C. | 五谷杂粮中含有的淀粉 | D. | 棉质衣服中的纤维素 |
5.已知卤代烃可以和钠发生反应,例如溴乙烷与钠反应为:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,应用这一反应,下列所给化合物中可以与钠合成环丁烷的是( )
| A. | CH3CH2Br | B. | CH3CH2CH2CH2Br | ||
| C. | CH2Br CH2CH2Br | D. | CH2Br CH2CH2CH2Br |
15.下列实验操作不正确的是( )
| 实验目的 | 实验操作 | |
| A | 验证化学反应中的能量变化 | 将NO2球浸泡在冰水,热水中观察颜色变化 |
| B | 证明非金属性:Cl>C>Si | 将纯碱与足量浓盐酸反应后产生的气体直接通入硅酸钠溶液中 |
| C | 探究相同条件下,溶液浓度对反应速率的影响 | 在两支试管中各加入4mL 0.01mol/L的KMnO4 酸性溶液,再分别加入0.1mol/L H2C2O4 溶液2mL、0.2mol/L H2C2O4溶液2mL,分别记录溶液褪色所需时间 |
| D | 除去氢氧化铁中少量的氢氧化铜 | 将过量氨水加入混合物中并充分搅拌,然后过滤、洗涤、干燥 |
| A. | A | B. | B | C. | C | D. | D |
2.下列表达正确的是( )
| A. | 羟基的电子式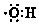 | B. | 醛基的结构简式-COH | ||
| C. | 2-丁烯的键线式  | D. | 2-丙醇的结构简式 C3H7-OH |

