题目内容
1.甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL 0.1mol•L-1 AlCl3溶液,两烧杯中都有沉淀生成.下列判断正确的是( )| A. | 甲中沉淀一定比乙中的多 | B. | 甲中沉淀可能比乙中的多 | ||
| C. | 甲中沉淀一定比乙中的少 | D. | 甲中和乙中的沉淀不可能一样多 |
分析 一水合氨是弱电解质、NaOH是强电解质,所以相同pH的氨水和NaOH溶液,c(氨水)>c(NaOH),相同体积、相同pH的氨水和NaOH溶液中n(氨水)>n(NaOH).氢氧化铝不溶液氨水,甲中发生:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,由于氢氧化铝能溶于强碱NaOH,乙中开始发生反应:Al3++4OH-=AlO2-+2H2O,而后发生反应:Al3++3AlO2-+6H2O=4Al(OH)3↓,再讨论过量情况进行分析解答.
解答 解:一水合氨是弱电解质、NaOH是强电解质,所以相同pH的氨水和NaOH溶液,c(氨水)>c(NaOH),相同体积、相同pH的氨水和NaOH溶液,n(氨水)>n(NaOH),二者和氯化铝反应都生成氢氧化铝沉淀,但氢氧化铝能溶于强碱NaOH,不溶于弱碱氨水.
氢氧化铝不溶液氨水,甲中发生:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,由于氢氧化铝能溶于强碱NaOH,乙中开始发生反应:Al3++4OH-=AlO2-+2H2O,而后发生反应:Al3++3AlO2-+6H2O=4Al(OH)3↓,
如果加入AlCl3恰好与NaOH反应生成Al(OH)3,由于参加反应的AlCl3的物质的量相等,所以生成沉淀质量相等;
如果加入AlCl3与NaOH反应生成Al(OH)3,后氯化铝还有剩余,则剩余部分氯化铝与氨水会继续反应生成沉淀,则氨水中产生的沉淀较多;
如果加入AlCl3与NaOH反应生成NaAlO2、Al(OH)3,则氨水中产生沉淀较多,
由上述分析可知,甲中沉淀大于或等于乙中,
故选:B.
点评 本题考查弱电解质的电离、氢氧化铝的性质,明确氢氧化铝的性质是解本题关键,要注意物质量的关系,分情况讨论,侧重考查学生分析问题、计算能力,题目难度中等.

| A. | 0.1 mol•L-1 | |
| B. | 一定大于0.1 mol•L-1 | |
| C. | 若为强酸一定等于0.1 mol•L-1,若为弱酸一定小于0.1 mol•L-1 | |
| D. | 若为强酸一定≤0.1 mol•L-1,若为弱酸一定>0.1 mol•L-1 |
| A. | 0.05mol•L-1的H2SO4 | B. | 0.1mol•L-1的KNO3 | ||
| C. | 0.1mol•L-1的KOH | D. | 0.1mol•L-1的NH4NO3 |
| A. | 锥形瓶洗净后还留有蒸馏水 | |
| B. | 取碱液的滴定管开始有气泡,放出液体后气泡消失 | |
| C. | 溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NaOH溶液无变化 | |
| D. | 用碱式滴定管取一定体积的NaOH溶液时,量取前仰视读数,量取后俯视读数 |
| A. | 有机物CH2Cl-CH2Cl用系统命名法命名为:二氯乙烷 | |
| B. | 1mol 与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol 与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol | |
| C. | 标准状况下,22.4L己烷所含分子数为NA | |
| D. | 乙醇与乙酸发生酯化反应时,乙醇分子中的碳氧键没断裂 |
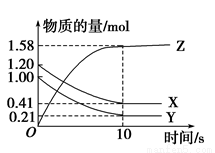
 Z(g)
Z(g)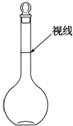 实验室配制480mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制480mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有: