题目内容
将钠、铝混合物W1g投入一定量水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L。向反应后的溶液中逐滴加入浓度为a mol·L-1的盐酸,在此过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2L,将溶液蒸干、灼烧得固体W2g。下列关系式错误的是
A.35.5aV2=W2-W1 B.23n(Na)+27n(Al)=W1
C.n(Na)+3n(Al)=2V1/22.4 D.aV2=V1/11.2
A
【解析】
试题分析:将钠、铝混合物放入水中发生反应为:2Na+2H2O=2NaOH+H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;向反应后的溶液中逐滴加入盐酸,在此过程中有白色沉淀生成后又逐渐溶解,AlO2-+H++H2O = Al(OH)3↓ ; Al(OH)3+3H+=Al3++3H2O。当沉淀恰好消失时溶液为AlCl3、NaCl。将溶液蒸干、灼烧得固体是Al2O3,其质量是W2g。n(Al)= 2(W2g÷102g/mol)= (W2/51)mol。n(Na)= [W1-27(W2/51)]/23mol。A. W1g是Na、Al的质量,W2g是Al2O3的质量。二者的质量差是Na、O元素的质量差,不是Cl元素的质量差,因此选项A错误;B.根据元素守恒可得:23n(Na)+27n(Al)=W1,正确;C.在反应过程中金属失去电子的物质的量与H+得到电子变为H2的物质的量相等。n(Na)+3n(Al)=2V1/22.4,正确;D.根据H、Cl元素守恒可得:aV2=(V1/22.4)×2 V1/11.2,正确。
考点:考查盐的水解、守恒方法在混合物的关系化学方程式的计算中的应用的知识。


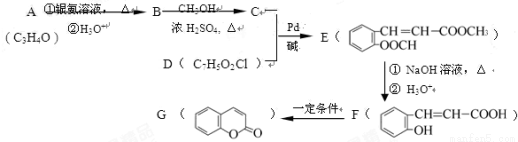
 )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体( )需要用到的试剂有:NaOH溶液、 。
)需要用到的试剂有:NaOH溶液、 。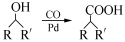 (R,R′为烃基),试写出以苯和丙烯(
(R,R′为烃基),试写出以苯和丙烯( =CH—CH3)为原料,合成
=CH—CH3)为原料,合成 的路线流程图(无机试剂任选)。合成路线流程图示例如下:
的路线流程图(无机试剂任选)。合成路线流程图示例如下:

 )>c(OH-)>c(H+)
)>c(OH-)>c(H+) )
)