题目内容
下列有关溶液中微粒的物质的量浓度的关系,正确的是
A.0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合的溶液:c(Cl-)>c(Na+)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c( )
)
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
D.某二元弱酸的酸式盐NaHA溶液:c(OH-)+c(H2A)=c(H+)+2c(A2-)
B
【解析】
试题分析:A、0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合的溶液,得到等浓度的氯化铵、一水合氨、氯化钠的混合液,溶液呈碱性,所以溶液中的离子浓度的大小关系是c(Cl-)> >c( )>c(Na+)>c(OH-)>c(H+),错误;B、等物质的量的NaClO、NaHCO3混合溶液中,根据物料守恒,可得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(
)>c(Na+)>c(OH-)>c(H+),错误;B、等物质的量的NaClO、NaHCO3混合溶液中,根据物料守恒,可得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c( ),正确;C、因为酸、碱的强弱未知,所以混合后溶液的酸碱性不能确定,错误;D、根据质子守恒,应有c(OH-)=c(H+)-c(A2-)+ c(H2A),则c(OH-)+c(A2-)=c(H+)+c(H2A),错误,答案选B。
),正确;C、因为酸、碱的强弱未知,所以混合后溶液的酸碱性不能确定,错误;D、根据质子守恒,应有c(OH-)=c(H+)-c(A2-)+ c(H2A),则c(OH-)+c(A2-)=c(H+)+c(H2A),错误,答案选B。
考点:考查溶液混合的计算,离子浓度的比较,守恒规律的应用

(10分) CO2和CH4是两种重要的温室气体,通过CH4和CO2反应来制造更高价值的化学品是目前的研究目标。
(1)250 ℃时,以镍合金为催化剂,向体积为4 L的密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 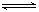 ?2CO(g)+2H2(g)。
?2CO(g)+2H2(g)。
平衡体系中各组分体积分数(某一成分物质的量占总气体物质的量的百分数)如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=________。
②已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+2.8 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1
反应CO2(g)+CH4(g) ===?2CO(g)+2H2(g) ΔH=________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300 ℃时,乙酸的生成速率减小的原因是__________________________________________________。

②将Cu2Al2O4溶解在稀硝酸中的离子方程式为_______________________________。
(3)以CO2为原料可以合成多种物质。
如合成聚碳酸酯。已知CO2的分子结构为O===C===O,它的“C===O”双键与乙烯的“C===C”双键一样,在一定条件下可发生加聚反应,聚碳酸酯是一种易降解的新型合成材料,它是由CO2加聚而成。写出聚碳酸酯的结构简式:______________________________________。
实验室中某些气体的制取、收集及尾气处理装置如图所示。

仅用此装置和表中提供的物质完成相关实验,最合理的是
选项 | a中物质 | b中物质 | c中收集的气体 | d中物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 饱和食盐水 | 电石 | CH≡CH | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
