题目内容
标准状况下,m1g气体A与m2g气体B的分子数相等,下列说法中正确的是( )
A、1个A分子的质量是1个B分子的质量的
| ||
B、同温同体积的A与B的质量比为
| ||
C、同温同体积的A与B的分子数比为
| ||
D、同温同压下A与B的密度比为
|
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:m1g气体A与m2g气体B的分子数相等,说明二者的物质的量相等,结合n=
=
计算.
| m |
| M |
| N |
| NA |
解答:
解:A.m1g气体A与m2g气体B的分子数相等,可知1个A分子的质量是1个B分子的质量的
倍,故A正确;
B.同温同体积时,但压强未知,不能确定气体的物质的量和质量关系,故B错误;
C.同温同体积时,但压强未知,不能确定气体的物质的量和分子数目关系,故C错误;
D.同温同压下,气体的密度之比等于摩尔质量之比,结合n=
=
可知为
,故D错误.
故选A.
| m1 |
| m2 |
B.同温同体积时,但压强未知,不能确定气体的物质的量和质量关系,故B错误;
C.同温同体积时,但压强未知,不能确定气体的物质的量和分子数目关系,故C错误;
D.同温同压下,气体的密度之比等于摩尔质量之比,结合n=
| m |
| M |
| N |
| NA |
| m1 |
| m2 |
故选A.
点评:本题考查阿伏伽德罗定律及其推论,为高频考点,侧重于学生的分析能力和计算能力的考查,注意对相关概念的理解和公式的运用,难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
物质在“潮湿的空气中”发生的变化,主要与空气中某些气体有关.下列说法不正确的是( )
| A、钢铁生锈与氧气、水蒸气有关,且以吸氧腐蚀为主 |
| B、氢氧化钠固体潮解、变质与水蒸气、二氧化碳有关 |
| C、浓硫酸露置于空气中浓度变小,与水蒸气有关 |
| D、钢铁在潮湿的空气中发生电化腐蚀,其正极的电极反应式为Fe-2e=Fe2+ |
短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素.原子半径X<Y<W<R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之种相等.下列说法不正确的是( )
| A、Y、Z、R的简单离子具有相同的电子层结构 |
| B、X、Z分别与Y均可形成A2B与A2B2型化合物,且A2B2均有较强的氧化性 |
| C、X2Y分子同存在氢键,故X2Y比X2W稳定 |
| D、由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
NA为阿伏伽德罗常数,下列叙述错误的是( )
| A、常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6NA |
| B、1mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
| C、由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA |
| D、6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
把20g氢氧化钠溶于水,配成500mL溶液,此溶液的物质的量浓度为( )
| A、2 mol?L-1 |
| B、1 mol?L-1 |
| C、0.5 mol?L-1 |
| D、1.5mol?L-1 |
最近,兰州近代物理研究所研制出我国首批氧-18气体(18O2).氧-18是氧的一种同位素,称为重氧,下列说法正确的是( )
| A、1.8g氧-18气体的物质的量是0.1mol |
| B、0.1mol重氧气体的体积是2.24L |
| C、重氧气体的摩尔质量为36g |
| D、0.1mol重氧水所含中子数约是6.02×1023个 |
常温下单质硫主要以S8形式存在.加热时,S8会转化为S6、S4、S2等.当温度达到750℃时,硫蒸气主要以S2形式存在(占92%).下列说法中正确的是( )
| A、S8转化为S6、S4、S2属于物理变化 |
| B、不论哪种硫分子,完全燃烧时都生成SO2 |
| C、S8、S6、S4、S2均属于共价化合物 |
| D、把硫单质在空气中加热到750℃即得S2 |
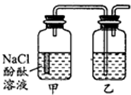 某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )
某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )| A、乙中导气管里形成一段水柱 |
| B、乙中导气管中产生气泡 |
| C、金属片剪口处溶液变红 |
| D、锌被腐蚀 |