题目内容
2.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).(1)向一定物质的量浓度的Cu(NO3)2 和Mn(NO3)2 溶液中加入Na2CO3 溶液,所得沉淀经高温灼烧,可制得CuMn2O4.
①写出基态Mn原子的价电子排布式为3d54s2,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1.
②CO32-的空间构型是平面三角形(用文字描述).
(2)在铜锰氧化物的催化下,CO 被氧化为CO2,HCHO 被氧化为CO2 和H2O.
①根据等电子体原理,CO 分子的结构式为C≡O.
②CO2 分子中C原子轨道的杂化类型为sp.
③1mol甲醛(HCHO)分子中含有的σ键数目为3×6.02×1023
(3)向CuSO4溶液中加入过量NH3﹒H2O溶液可生成[Cu (NH3)4]SO4,其中配位体为NH3,内界[Cu (NH3)4]2+中含有的化学键有bc(写选项).
a.离子键 b.共价键 c.配位键 d..金属键.
分析 (1)①Mn原子核外电子数为25,处于第四周期ⅦB族;Cu原子核外电子数为29,根据能量最低原理书写核外电子排布式;
②计算C原子价层电子对数、孤电子对数确定空间构型;
(2)①CO与N2互为等电子体,二者结构相似,CO分子中C原子与氧原子之间形成3对共用电子对;
②CO2 分子中C原子序数2个σ键,没有孤电子对,杂化轨道数目为2;
③HCHO分子中含有2个C-H键、1个C=O双键,分子中含有3个σ键;
(3)配体含有孤电子对,中心离子含有空轨道;[Cu (NH3)4]2+中铜离子与氨气分子之间形成配位键,氨气分子中含有共价键.
解答 解:(1)①Mn原子核外电子数为25,处于第四周期ⅦB族,价电子排布式为3d54s2,Cu原子核外电子数为29,核外电子排布式为1s22s22p63s23p63d104s1,
故答案为:3d54s2;1s22s22p63s23p63d104s1;
②CO32-中C原子孤电子对数=$\frac{4+2-2×3}{2}$=0,价层电子对数=3+0=3,空间构型为平面三角形,
故答案为:平面三角形;
(2)①CO与N2互为等电子体,二者结构相似,CO分子中C原子与氧原子之间形成3对共用电子对,CO结构式为C≡O,故答案为:C≡O;
②CO2 分子中C原子序数2个σ键,没有孤电子对,杂化轨道数目为2,C原子采取sp杂化,故答案为:sp;
③HCHO分子中含有2个C-H键、1个C=O双键,分子中含有3个σ键,1mol甲醛(HCHO)分子中含有的σ键数目为3×6.02×1023,故答案为:3×6.02×1023;
(3)[Cu (NH3)4]SO4中配位体为NH3,[Cu (NH3)4]2+中铜离子与氨气分子之间形成配位键,氨气分子中含有共价键,
故答案为:NH3;bc.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型判断、等电子体、化学键、配合物等,注意对基础知识的理解掌握.

| A. | 向某溶液中滴入盐酸,有无色无味的气体产生,说明某溶液一定含有含CO32- | |
| B. | 向某溶液中加入NaOH溶液,并加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明某溶液中一定含有NH4+ | |
| C. | 向某溶液中滴加氯化钡溶液,得到白色沉淀,说明某溶液中一定含有SO42- | |
| D. | 向某溶液中加入过量的NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明某溶液中一定含有Fe2+,一定不含有Al3+ |
| A. | 二氧化碳  | B. | 次氯酸的结构式 H-Cl-O | ||
| C. | 铝离子的结构示意图  | D. | 氯化铯的晶体结构(晶胞)模型 |
| A. | CH4 | B. | CO2 | C. | NaHCO3 | D. | CH3COOH |

| A. | 其一氯代物只有一种 | B. | 其二氯代物有三种同分异构体 | ||
| C. | 常温下为气体 | D. | 它与苯乙烯( )互为同分异构体 )互为同分异构体 |
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有HClO | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向品红溶液中滴加氯水,溶液褪色,说明氯水中含有HCl |
| A. | 含有较多H+的溶液 | B. | pH<7的溶液 | ||
| C. | c(OH-)<c(H+)的溶液 | D. | 滴加酚酞显无色溶液 |
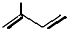 :2-甲基-1,3-丁二烯;该物质与溴单质以物质的量之比1:1发生加成反应可能的产物有3 种;
:2-甲基-1,3-丁二烯;该物质与溴单质以物质的量之比1:1发生加成反应可能的产物有3 种;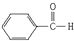 :苯甲醛;
:苯甲醛;