题目内容
9.总压强为3.30×107pa时,N2和H2混合气体,通入合成塔,反应达到平衡时,压强减为2.525×107pa,则平衡时氨的体积百分率是( )| A. | 30% | B. | 20% | C. | 15% | D. | 10% |
分析 根据反应:N2+3H2?2NH3,气体体积减少量就是氨气的量,设混合气体为a体积,生成氨气的体积为b,由题意可知:$\frac{a}{a-b}=\frac{3.30×1{0}^{7}pa}{2.525×1{0}^{7}pa}$,据此可计算出氨气的体积分数.
解答 解:根据反应:N2+3H2?2NH3,气体体积减少量就是氨气的量,设混合气体为a体积,生成氨气的体积为b,由题意可知:$\frac{a}{a-b}=\frac{3.30×1{0}^{7}pa}{2.525×1{0}^{7}pa}$,所以$\frac{b}{a-b}$=$\frac{3.30-2.525}{2.525}$×100%=30%,故选A.
点评 本题考查化学方程式计算,难度不大,注意充分利用反应前后的压强之比进行计算.

练习册系列答案
相关题目
19.下列化学实验事实及其解释都正确的是( )
| A. | 氯气可以使湿润的有色布条褪色,是因为氯气分子能漂白有机分子 | |
| B. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| C. | 用饱和Na2CO3溶液可将BaSO4转化为BaCO3,说明Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | 某溶液用盐酸酸化无明显现象,再滴加氯化钡溶液有白色沉淀,说明溶液中有SO42- |
20.下列除杂方案错误的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 |
| A | FeCl3(aq) | Al3+(aq) | NaOH溶液、盐酸 |
| B | AlCl3(aq) | Cu2+ | Al粉 |
| C | NaHCO3(aq) | Na2CO3(aq) | CO2气体 |
| D | FeCl3(aq) | Cu2+ | Fe粉 |
| A. | A | B. | B | C. | C | D. | D |
17.某镁盐溶液中含有杂质离子 Cr3+,所含主要离子及其浓度如下表所示(H+ 和 OH-未列出):
已知 25℃时,Ksp[Cr(OH)3]=10-32;Ksp[Mg (OH)2]=5×10-11;操作过程中溶液体积的变化忽略不计.
(1)表格中的 a>1.03(填“<”、“>”或“=”).
(2)除去杂质Cr3+离子,可加入MgO调节溶液 pH,理论上应调节pH的范围是5≤pH<9.
(3)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2?6H2O)的操作是在HCl氛围中加热浓缩,冷却结晶,过滤.
| 离子 | Mg2+ | Cr3+ | Cl- |
| 浓度(mol/L) | 0.5 | 0.01 | a |
(1)表格中的 a>1.03(填“<”、“>”或“=”).
(2)除去杂质Cr3+离子,可加入MgO调节溶液 pH,理论上应调节pH的范围是5≤pH<9.
(3)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2?6H2O)的操作是在HCl氛围中加热浓缩,冷却结晶,过滤.
4.分子式为C6H12O2的酯共有(不考虑立体异构)( )
| A. | 18种 | B. | 19种 | C. | 20种 | D. | 21种 |
14.欲将 转化为
转化为 ,可以加入( )
,可以加入( )
 转化为
转化为 ,可以加入( )
,可以加入( )| A. | 水 | B. | 碳酸氢钠溶液 | C. | 碳酸 | D. | 盐酸 |
6.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L H2O含有的分子数为NA | |
| B. | 常温常压下,1.06克Na2CO3含有的Na离子数为0.02NA | |
| C. | 通常状况下,1NA个H2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl离子个数为NA |

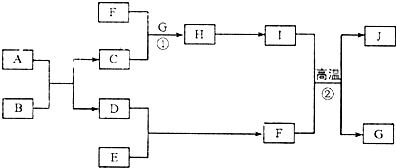
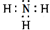 ,含有的化学键类型是极性共价键
,含有的化学键类型是极性共价键