题目内容
7.有一硫酸和硝酸的混合溶液,取出100mL加入足量BaCl2溶液,过滤,洗涤,烘干后得到93.2g沉淀;滤液与4mol•L-1NaOH溶液反应,消耗400mLNaOH溶液时恰好完全中和.计算:(1)混合溶液中硫酸、硝酸的物质的量浓度;
(2)另取100mL原混合溶液稀释至200mL,加入44.8g铜粉共热,可收集到的气体在标准状况下的体积.
分析 (1)酸与硝酸的混合溶液,取出100mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到93.2g的沉淀为硫酸钡,根据n=$\frac{m}{M}$计算硫酸钡的物质的量,再根据硫酸根守恒n(H2SO4)=n(BaSO4),滤液中氢离子物质的量不变,与4mol•L-1NaOH溶液反应,用去400mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),根据c=$\frac{n}{V}$计算硫酸、硝酸的物质的量浓度;
(2)发生反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,先判断过量情况,然后根据不足量计算.
解答 解:(1)硫酸与硝酸的混合溶液,取出100mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到93.2g的沉淀为硫酸钡,
硫酸根守恒故n(H2SO4)=n(BaSO4)=$\frac{93.2g}{233g/mol}$=0.4mol,故原溶液中c(H2SO4)=$\frac{0.4mol}{0.1L}$=4mol/L;
滤液中氢离子物质的量不变,与4mol•L-1NaOH溶液反应,用去40mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),即n(HNO3)+2×0.4mol=0.4L×4mol/L,解得n(HNO3)=0.8mol,故原溶液中c(HNO3)=$\frac{0.8mol}{0.1L}$=8mol/L,
答:混合液中H2SO4的物质的量浓度为4mol/L、HNO3的物质的量浓度是8mol/L;
(2)44.8gCu的物质的量为:$\frac{44.8g}{64g/mol}$=0.7mol,
溶液中H+离子的物质的量为:100×10-3×(4×2+8×1)mol=1.6mol,
溶液中含有NO3-的物质的量为:100×10-3L×8mol/L=0.8mol,
发生反为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
3mol 8mol 2mol 44.8L
0.7mol 1.6mol 0.8mol V
1.6molH+完全反应消耗0.4molNO3-、0.6molCu,显然H+不足,
所以生成NO的体积按照氢气的物质的量计算,
则:$\frac{8mol}{1.6mol}$=$\frac{44.8L}{V}$,
解得:V=8.96 L,
答:收集到气体在标准状况下的体积为8.96 L.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,(2)为易错点,正确判断过量情况为解答关键,试题培养了学生的化学计算能力.

| A. | 0.1mol•L-1Na2S溶液中:c(OH-)=c(H2S)+c(HS-) | |
| B. | 0.1mol•L-1 CH3COONH4溶液中:c(NH4+)+c(NH3•H2O)=c(CH3COO-)+c(CH3COOH) | |
| C. | 0.1mol•L-1pH=6的NaHSO3溶液中:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) | |
| D. | 0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液中:c(CO32-)>c(HCO3-)>c(OH-)>c(H2CO3) |
①缩小体积 ②升高温度 ③通入CO2④增加碳的量 ⑤降低压强.
| A. | ①②③④ | B. | ②③④⑤ | C. | ①②③ | D. | ②③④ |
 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料 电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料 电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| B. | 每消耗3 mol H2O2,转移的电子为6 mol | |
| C. | b电极为正极,发生氧化反应 | |
| D. | 该电池的负极反应为:BH4-+8OH-+8e-═BO2-+6H2O |
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
 (b)、
(b)、 (d)、
(d)、 (p)的说法正确的是( )
(p)的说法正确的是( )| A. | b、d和p是同分异构体 | |
| B. | b、d、p的二氯代物均只有三种 | |
| C. | b、d、p均可与酸性高锰酸钾溶液反应 | |
| D. | b、d、p中只有b的所有原子处于同一平面 |
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 苯(苯酚) | NaOH溶液 | 过滤 |
| C | 乙醇(乙酸) | CaO | 蒸馏 |
| D | 乙烷(乙烯) | 溴水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
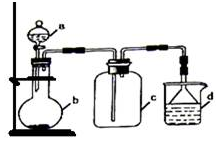 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |

