题目内容
3.下列各项中前后两个叙述都正确的是( )| A. | 单质分子中一定存在共价键;最外层有2个电子的原子都是金属原子 | |
| B. | 非极性键可以存在于离子化合物中; 质子数相同的粒子不一定属于同种元素 | |
| C. | 同位素的化学性质几乎完全相同;任何原子的原子核都是由质子和中子构成的 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构; 伴有能量变化的物质变化都是化学变化 |
分析 A.稀有气体分子中不存在共价键;稀有气体He最外层含有2个电子,但属于非金属原子;
B.离子化合物可能存在非极性键,也能存在极性键;粒子包括分子、原子、阴阳离子等,所以质子数相同的粒子不一定属于同种元素;
C.互为同位素原子,核外电子排布相同,最外层电子数决定化学性质;有的原子中不存在中子,如质量数为1的H;
D.PCl3分子中所有原子的最外层都达到8电子稳定结构;BCl3分子中B原子的最外层电子数为6;伴有能量变化的物质变化不一定发生化学反应.
解答 解:A.单质分子中不一定存在共价键,如稀有气体的单质为单原子构成的分子,则不存在化学键;He最外层有2个电子,但He属于非金属元素,故A错误;
B.非极性键既能存在于离子化合物中,如过氧化钠为离子化合物,过氧化钠中含有非极性键;质子数相同的粒子不一定属于同种元素,例如1个水分子、1个氨气分子、1个甲烷分子中,都含有10个质子,但是不属于同种元素,故B错误;
C.互为同位素原子,核外电子排布相同,最外层电子数决定化学性质,同位素的化学性质几乎完全相同;一般来讲,原子的原子核是由质子和中子构成的,但有的原子不含中子,如质量数为1的H原子,故C错误;
D.PCl3分子中所有原子的最外层都达到8电子稳定结构;BCl3分子中B原子的最外层电子数为6,Cl原子的最外层电子数为8;物质的三态变化是物理变化,有能量变化,所以伴有能量变化的物质变化不一定是化学变化,故D错误;
故选B.
点评 本题考查较为综合,涉及化学键、化学反应与能力变化的关系、原子核外电子排布等知识,注意掌握化合物与含有化学键的关系,D为易错点,注意存在能力变化的不一定为吸热反应或放热反应,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
13.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.
甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为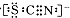
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-.
④若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
| 操 作 | 现 象 |
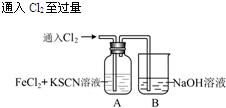 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.
甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
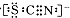
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-.
④若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
11.某炔烃与氢气加成后生成2-甲基戊烷,该炔烃可能的结构有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
18.将一定量的锌与100mL 18.5mol/L浓硫酸充分反应,锌完全溶解,同时生成气体A 33.6L(标准状况).将反应后溶液稀释至1L,测得溶液的pH=1,下列叙述错误的是( )
| A. | 气体A为SO2和H2的混合物 | B. | 气体A中SO2与H2的体积比为5:1 | ||
| C. | 反应中共消耗Zn 97.5g | D. | 反应中共转移电子3mol |
15.下列晶体中,含有非极性共价键的离子晶体是( )
| A. | SiO2 | B. | KOH | C. | Na2O2 | D. | I2 |
12.在一定条件下发生下列反应,其中属于盐类水解反应的是( )
| A. | NH4++2H2O?NH3•H2O+H3O+ | B. | AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | ||
| C. | HS-+H+?H2S | D. | Cl2+H2O?H++Cl-+HClO |
13.常温下铁片插入下列物质中,铁片质量不会发生变化的是( )
| A. | 浓H2SO4溶液 | B. | FeCl3溶液 | C. | KSCN溶液 | D. | AgNO3溶液 |