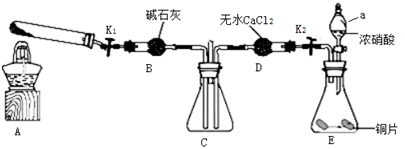
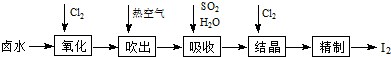
题目内容
16.在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③17.6g CO2 ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是( )a.体积②>③>①>④b.密度③>②>④>①
c.电子总数②>③>①>④d.原子总数①>③>②>④
| A. | abcd | B. | bcd | C. | acd | D. | abc |
分析 ①6.72L CH4 物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,
②3.01×1023个HCl分子的物质的量为0.5mol,
③17.6g CO2的物质的量为$\frac{17.6g}{44g/mol}$=0.4mol,
④0.2mol NH3;
a.气体体积V=nVm;
b.气体密度=$\frac{M}{{V}_{m}}$;
c.根据N=nNA计算分子总数,再结合分子中电子数计算电子总数;
d.根据N=nNA计算分子总数,再结合分子中原子个数计算原子总数.
解答 解:①6.72L CH4 物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,
②3.01×1023个HCl分子的物质的量为0.5mol,
③17.6g CO2的物质的量为$\frac{17.6g}{44g/mol}$=0.4mol,
④0.2mol NH3;
a.根据V=nVm知,相同条件下,气体的体积之比等于物质的量之比,所以体积体积②>③>①>④,故正确;
b.气体密度=$\frac{M}{{V}_{m}}$,各物质的摩尔质量分别为①CH4 为16g/mol②HCl为36.5g/mol ③CO2为44g/mol④NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度③>②>④>①,故正确;
c.根据N=nNA知,分子数与物质的量成正比,所以分子总数②>③>①>④,甲烷分子中含有10个电子、HCl中含有18个电子、CO2分子中含有22个电子、氨气分子中含有10个电子,所以电子的物质的量分别是3mol、9mol、8.8mol、2mol,所以电子总数②>③>①>④,故正确;
d.根据N=nNA知,分子数与物质的量成正比,所以分子总数②>③>①>④,甲烷分子中含有5个原子、HCl分子中含有2个原子、CO2分子中含有3个原子、氨气分子中含有4个原子,所以原子的物质的量分别为1.5mol、1mol、1.2mol、0.8mol,所以原子总数①>③>②>④,故正确;
故选A.
点评 本题考查阿伏伽德罗定律,为高频考点,侧重考查学生分析计算能力,明确各个物理量的关系及分子构成是解本题关键,注意气体摩尔体积适用范围及其适用条件,注意计算分子中电子数的方法,为易错点.

| A. | 14C的质量数为14g•mol-1 | B. | 14C与12C是两种不同的元素 | ||
| C. | 14C与C60互为同素异形体 | D. | 14C与14N中子数一定不同 |
| A. | 钢铁腐蚀时可能发生的正极反应为:2H2O+O2+4e-=4OH- | |
| B. | 向沸水中滴入几滴FeC13溶液:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| C. | 1L0.5mol•L-1稀硫酸与1L1mol•L-1氢氧化钠溶液反应放出57.3kJ的热量: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6kJ•mol-1 | |
| D. | 向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O |
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. | 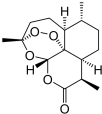 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| C. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既不是氧化剂又不是还原剂 | D. | 既是氧化剂又是还原剂 |
| A. | Fe | B. | N2 | C. | CH3CH2OH | D. | CO |