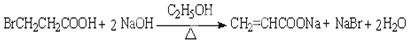题目内容
10.基态原子的核外电子排布为4d105s1的元素应在( )| A. | S区、第五周期、ⅠA族 | B. | ds区、第五周期、ⅠB族 | ||
| C. | d区、第四周期、ⅠB族 | D. | ds区、第五周期、ⅠA族 |
分析 根据基态原子的核外电子排布为4d105s1,可知该元素原子核外有5个电子层,最外层有1个电子,根据周期表位置判断分区.
解答 解:已知基态原子的核外电子排布为4d105s1,可知该元素原子核外有5个电子层,最外层有1个电子,在周期表中位置为第五周期、IB族,属于ds区;
故选B.
点评 本题考查了元素在周期表中位置的判断,注意掌握根据电子排布式来判断元素位置的方法,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列关于热化学反应的描述中正确的是( )
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和NaOH完全反应的中和热为-114.6kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g);△H=-283.0kJ/mol | |
| C. | 一个化学反应的热效应,只与反应的始态与终态有关,与反应的过程无关 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
1.将收集满纯净氯化氢气体的试管倒立在盛有紫色石蕊试液的水槽中,可以看到( )
| A. | 试管中液面略有上升 | B. | 液面升至试管的$\frac{1}{2}$处 | ||
| C. | 红色液体几乎充满试管 | D. | 无明显现象 |
5.下列物质中只有离子键的是( )
| A. | NaOH | B. | CaBr2 | C. | H2 | D. | H2S |
19.已知NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 标准状况下,2.24L H2O含有的分子数为0.1NA | |
| B. | 标准状况下,2.24L H2 含有的分子数为0.1mol | |
| C. | 分子数为NA 的CO和N2混合气体的体积约为22.4L,质量为28g | |
| D. | 1mol CH4分子中所含的电子总数为10 NA |
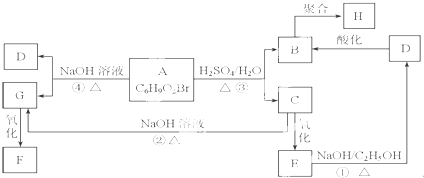
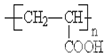 ;
;