题目内容
19.二氧化氯(ClO2)在水处理等方面有广泛应用,制备ClO2有下列两种方法:Na2SO4方法一:2NaClO3+H2O2+H2SO4═2ClO2↑+O2↑+Na2SO4+2H2O
方法二:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O
(1)方法一中空白处的物质的化学式是Na2SO4(该化学方程式已配平),反应的还原剂是H2O2.若反应中电子转移数为0.1NA,则产生的气体标准状况下的体积为3.36L.
(2)方法二中盐酸表现的性质是还原性、酸性,该反应的还原产物是ClO2.
(3)根据方法二,实验室用NaClO3和8mol/L的盐酸反应即可反应制得ClO2.若使用12mol/L盐酸配制8mol/L的盐酸,实验室中需用到的计量仪器有量筒、容量瓶.所用的浓盐酸长时间放置在密闭性不好的容器中,最终所配制的盐酸的浓度有无变化?偏低(填“偏高”、“偏低”或“无影响”)
分析 (1)根据质量守恒,分析方法一中空白处的物质的化学式,反应中过氧化氢中氧的化合价升高,失去电子,由反应2NaClO3+H2O2+H2SO4═2ClO2↑+O2↑+Na2SO4+2H2O可知,生成3mol的气体转移电子的数目为:2mol,由此分析解得产生的气体标准状况下的体积;
(2)2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O中盐酸中氯的化合价升高是还原剂,所以现的性质是还原性、酸性,该反应的还原产物是二氧化氯;
(3)配制一定浓度的溶液用容量瓶、量取液体用量筒;根据c=$\frac{n}{V}$分析解答.
解答 解:(1)根据质量守恒,方法一中空白处的物质的化学式为Na2SO4,反应中过氧化氢中氧的化合价升高,所以过氧化氢是还原剂,由反应2NaClO3+H2O2+H2SO4═2ClO2↑+O2↑+Na2SO4+2H2O可知,生成3mol的气体转移电子的数目为:2mol,所以若反应中电子转移数为0.1NA,生成气体标准状况下的体积为 3.36L,故答案为:Na2SO4;H2O2; 3.36L;
(2)2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O中盐酸中氯的化合价升高是还原剂,同时电离产生的氢离子与氧负离子结合成水,所以现的性质是还原性、酸性,该反应的还原产物是二氧化氯,故答案为:还原性、酸性; ClO2;
(3)配制一定浓度的溶液用容量瓶、量取液体用量筒,用的浓盐酸长时间放置在密闭性不好的容器中,导致盐酸挥发,所以物质的量减小,盐酸的物质的量浓度偏低,故答案为:量筒、容量瓶;偏低.
点评 本题考查离子反应及氧化还原反应,明确氧化还原反应中元素的化合价变化是解答的关键,题目难度不大.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | CH3CH2CH3分子中的3个碳原子不可能在同一直线上 | |
| C. | 聚氯乙烯、麦芽糖和蛋白质均属于有机高分子化合物 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |
14.相同质量的下列烃,在空气中充分燃烧产生二氧化碳最少的是( )
| A. | C2H2 | B. | C3H6 | C. | C4H10 | D. | C6H6 |
4.下列说法中正确的是( )
| A. | 分子间作用力越大,分子越稳定 | |
| B. | 分子间作用力越大,物质的熔、沸点越高 | |
| C. | 相对分子质量越大,其分子间作用力越大 | |
| D. | 分子间只存在范德华力 |
11.下列化学用语表示正确的是( )
| A. | HClO的结构式:H-Cl-O | B. | MgO的电子式:Mg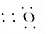 | ||
| C. | 四氯化碳分子比例模型: | D. | 聚四氟乙烯的结构简式: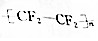 |
8.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| B. | 标准状况下,2.24L NO与11.2L O2混合后气体的分子数小于NA | |
| C. | 120g熔融的NaHSO4中含阳离子总数为2NA | |
| D. | 用5mL 3mol/L FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015NA |
9.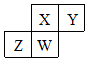 短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,W原子的质子数是其最外层电子数的三倍.下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,W原子的质子数是其最外层电子数的三倍.下列说法不正确的是( )
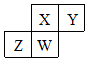 短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,W原子的质子数是其最外层电子数的三倍.下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,W原子的质子数是其最外层电子数的三倍.下列说法不正确的是( )| A. | 元素Y有同素异形体 | |
| B. | 最高价氧化物对应水化物的酸性:X>Z | |
| C. | 简单气态氢化物的热稳定性:Y>Z | |
| D. | 原于半径:W>Z>Y>X |