题目内容
1.已知提示:物质的转化率(%)=$\frac{反应物转化的物质的量}{反应物起始的物质的量}$×100%在2L的容器中进行下列可逆反应,各物质的有关数据如下:
aA (g)+bB (g)?2C(g)
起始物质的量(mol):1.5 1 0
2s末物质的量 (mol):0.9 0.8 0.4
则:①该可逆反应的化学方程式可表示为3A(g)+B(g)?2C(g);
②0到2s用物质B来表示的反应速率为0.05mol/(L•s);
③从反应开始到2s末,A的转化率为40%;
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是BE.
A.vB(反应)=vC(生成)
B.容器内气体的总压强保持不变
C.容器内气体的密度不变
D.vA:vB:vC=3:2:2
E.容器内气体C的物质的量分数保持不变.
分析 ①速率之比等于对应物质的化学计量数之比;
②0到2s用物质B来表示的反应速率为$\frac{\frac{0.2mol}{2L}}{2s}$=0.05 mol/(L•s);
③物质的转化率(%)=$\frac{反应物转化的物质的量}{反应物起始的物质的量}$×100%;
④根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①速率之比等于对应物质的化学计量数之比,所以a:b:c=0.6:0.2:0.4,而c=2,则a=3,b=1,所以化学方程式为:3A (g)+B (g)?2C(g),
故答案为:3A (g)+B (g)?2C(g);
②0到2s用物质B来表示的反应速率为$\frac{\frac{0.2mol}{2L}}{2s}$=0.05 mol/(L•s),故答案为:0.05 mol/(L•s);
③物质的转化率(%)=$\frac{反应物转化的物质的量}{反应物起始的物质的量}$×100%=$\frac{0.6}{1.5}×100%$=40%,故答案为:40%;
④A.vB(反应)=vC(生成),不等于计量数之比,故A错误;
B.容器内气体的总压强保持不变,说明气体的物质的量相等,反应达平衡状态,故B正确;
C.容器内气体的密度一直不变,故C错误;
D.只要反应发生vA:vB:vC=3:1:2,故D错误;
E.容器内气体C的物质的量分数保持不变,说明各组分的物质的量不变,反应达平衡状态,故E正确;
故选BE.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

| A. | 0.4mol H2 | B. | 8.8g CO2 | ||
| C. | 6.02×1022个CH4 | D. | 4.48L NH3(标准状况下) |
| A. |  除去乙醇中的乙酸 | B. |  形成原电池 | ||
| C. | 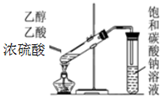 制取乙酸乙酯 | D. |  收集NH3 |
| A. | G+H=W,其它条件相同时,分别在200℃和100℃下进行反应 | |
| B. | 相同温度下,颗粒相同的锌粒分别与H+浓度相同的硫酸和盐酸反应 | |
| C. | A+B=C(500℃下进行) D+E=F(100℃下进行) | |
| D. | 相同温度下,锌粒与铁粉分别与同浓度的盐酸反应 |
①都是主族元素,原子的最外层电子数都大于3
②单质在反应中都只能作氧化剂
③对应的含氧酸都是强酸
④氢化物常温下都是气态,所以又叫气态氢化物
⑤气态氧化物与水反应都不会再生成气体.
| A. | 只有①②④⑤ | B. | 全部 | C. | 只有①② | D. | 只有①②③④ |
 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)$\frac{\underline{\;电解\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)$\frac{\underline{\;电解\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生电解反应2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数不同 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阴极,铁为阳极 |
| A. | 构成单质分子的粒子一定含共价键 | |
| B. | 非金属元素组成的化合物一定不是离子化合物 | |
| C. | 第ⅠA族和第ⅦA族原子化合时一定形成离子键 | |
| D. | 共价化合物中一定不含离子键 |
| A. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA | |
| B. | 500mL0.1mol/L盐酸中,含有HCl分子数目为0.05NA | |
| C. | 1molNa被氧化生成NaNO3水溶液或NaCl,都失去NA个电子 | |
| D. | 1.0L1.0mol•L-1的NaNO3水溶液中含有的氧原子数为3NA |
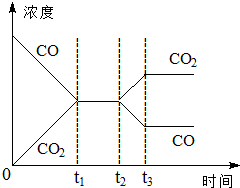 在一个恒容反应器中发生反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如表:
在一个恒容反应器中发生反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如表:| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(2)830℃时,向反应器中投入1mol CO(g)、2mol H2O(g)、xmol H2(g)和0.5mol CO2(g)发生上述反应,要使反应开始时向逆反应方向进行,x的取值范围是x>4.
(3)若反应器绝热,判断该反应达到平衡状态的标志是①④(填序号)
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④各组分的物质的量浓度不再改变
⑤消耗1mol H2O(g)的同时,生成1mol CO2(g)
(4)如图表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件浓度变化的情况,图中t2时刻发生改变的条件可能是降低温度,或增加水蒸汽的量,或减少氢气的量(写出两种).