题目内容
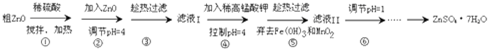
5.印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费.可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用.测得某废腐蚀液中含CuCl2 1.5mol/L,FeCl2 3.0mol/L,FeCl3 1.0mol/L,HCl 3.0mol/L.取废腐蚀液200mL按如下流程在实验室进行实验:
回答下列问题:
(1)上述方法获得的铜粉中含有杂质,除杂所需试剂是HCl(填化学式).
(2)实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物.反应的化学方程式为KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O.
(3)如图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置.

实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收.控制生成氯气速度的操作是:缓慢旋动分液漏斗的活塞,调节液体滴下的速度.
(4)按上述流程操作,需称取Fe粉的质量应不少于39.2g(精确到0.1g),需通入Cl2的物质的量不少于0.75mol.
分析 腐蚀废液中加入过量的铁粉,三价铁离子与铁反应生成二价铁离子,铜离子与铁反应生成铜和二价铁离子,搅拌过滤得到固体铜和过量的铁粉,滤液为氯化亚铁溶液,向滤渣中加入足量盐酸或稀硫酸溶解铁粉过滤得到纯净的铜,向氯化亚铁溶液中通入氯气反应生成氯化铁,
(1)铜与盐酸不反应,铁粉与盐酸反应生成氯化亚铁;
(2)固体KClO3与浓HCl反应生成氯气和氯化钾、水;
(3)要控制反应生成氯气的速率可以通过调节液漏斗的活塞,控制浓盐酸的加入量;
(4)根据铁与CuCl2、FeCl3、HCl反应求出参加反应的铁粉的质量;根据Cl2与FeCl2反应生成FeCl3计算出Cl2的物质的量;
解答 解:(1)铜与盐酸不反应,铁粉与盐酸反应生成氯化亚铁,所以加入盐酸可以除去铜中的铁粉,
故答案为:HCl;
(2)固体KClO3与浓HCl反应生成氯气和氯化钾、水,化学方程式:KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O,
故答案为:KClO3+6HCl(浓)=3Cl2↑+KCl+3 H2O;
(3)缓慢旋动分液漏斗的活塞,调节液体滴下的速度,可以控制生成氯气速度,
故答案为:缓慢旋动分液漏斗的活塞,调节液体滴下的速度;
(4)加入铁粉后,分别于氯化铜、氯化铁、盐酸反应,
Fe+CuCl2 =FeCl2 +Cu
0.3mol 1.5mol•L-1×0.2L 0.3mol
Fe+2FeCl3 =3FeCl2
0.1mol 1.0mol•L-1×0.2L 0.3mol
Fe+2HCl=FeCl2 +H2↑
0.3mol 3.0mol•L-1×0.2L 0.3mol
共消耗Fe粉的物质的量为0.3mol+0.1mol+0.3mol=0.7mol,质量为0.7mol×56g/mol=39.2g,
Cl2 +2FeCl2 =2FeCl3
0.75mol 1.5mol
所以共消耗氯气的物质的量为0.75mol;
故答案为:39.2;0.75.
点评 本题考查了铁及其化合物的性质、氯气的制备、有关方程式的计算,题目难度不大,熟悉物质的性质和反应原理是解题关键.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案| A. | 明矾--Al2(SO4)3•12H2O | B. | 漂白粉--NaClO | ||
| C. | 纯碱--NaHCO3 | D. | 水煤气--CO、H2 |
| A. | C2H5OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O | |
| B. | H-C≡C-H+HCl$\stackrel{催化剂}{→}$H2C=CHCl | |
| C. | 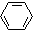 +HNO3$→_{60℃}^{浓硫酸}$ +HNO3$→_{60℃}^{浓硫酸}$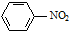 +H2O +H2O | |
| D. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$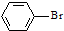 +HBr +HBr |
| A. | 因为反应物浓度越大,反应速率越快,所以常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 | |
| B. | 增大反应物浓度可加快反应速度,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| C. | 对化学反应速率起决定性作用的因素是参加反应的各物质的性质 | |
| D. | 化学反应速率也可以用单位时间内固体物质的消耗量或者气体物质的生成量来表示 |



 与
与 D.乙烯与1-丁烯 E、乙烷与2,3-二甲基丁烷
D.乙烯与1-丁烯 E、乙烷与2,3-二甲基丁烷 碳和硫的化合物在生产和生活中的应用非常广泛,清洁能源的开发、煤的综合利用等是实验“低碳生活”、减少空气污染的重要途径,试运用所学知识,回答下列问题:
碳和硫的化合物在生产和生活中的应用非常广泛,清洁能源的开发、煤的综合利用等是实验“低碳生活”、减少空气污染的重要途径,试运用所学知识,回答下列问题: