题目内容
13.在20℃时,氯化钠的溶解度为36g,取一定量该温度下的饱和氯化钠溶液用惰性电极进行电解.当阳极产生气体为11.2L(标准状况)时,氯化钠完全电解,所得溶液的密度为1.2g/mL.试计算:(1)要使溶液恢复至原状态,需要加入36.5 g 的氯化氢气体(填物质名称).
(2)电解时所取饱和氯化钠溶液的质量是221 g.
(3)电解后溶液的体积是153.75 mL.
(4)电解后溶液的物质的量浓度是6.50 mol•L-1.
分析 (1)根据电解质复原的原则:少什么加什么,结合元素守恒确定加入物质的质量;
(2)根据溶解度计算质量分数,根据电解产生的氯气的量计算溶质氯化钠的质量,进而计算溶液质量;
(3)溶液的体积V=$\frac{m}{ρ}$;
(4)根据电解方程式结合氯气的量计算氢氧化钠的量,根据公式c=$\frac{n}{V}$计算物质的量浓度.
解答 解:(1)当阳极析出11.2L即0.5mol气体(标准状况)时,阳极上是氯离子失电子,电极反应为:2Cl--2e-═Cl2↑,所以放电的氯离子是1mol,要使溶液恢复到原状态,需加入HCl气体,根据氯元素守恒,加入HCl的物质的量是1mol,质量是36.5g;
故答案为:36.5g;氯化氢气体;
(2)由氯原子守恒可知,氯化钠的物质的量是1mol,质量是58.5g,该温度下的饱和溶液的质量分数=$\frac{36g}{136g}$=$\frac{9}{34}$,所取饱和食盐水的质量=$\frac{58.5g}{\frac{9}{34}}$=221g,
故答案为:221;
(3)溶液的体积V=$\frac{m}{ρ}$=$\frac{221g}{1.2g/mL}$=153.75 mL;
故答案为:153.75;
(4)由2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,由以上分析可知,氯化钠为1mol,则生成NaOH为1mol,所以电解后溶液的浓度为c=$\frac{n}{V}$=$\frac{1mol}{0.15375L}$=6.50mol/L;
故答案为:6.50.
点评 本题涉及电解池的工作原理、质量分数的计算以及电解质复原的方法知识,属于综合知识的考查题,难度中等,侧重于考查学生对基础知识的综合应用能力和计算能力.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴等浓度 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡;试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
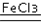 2H2O+O2↑.
2H2O+O2↑.(2)实验①的目的是研究温度对H2O2分解速率的影响.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率 (用实验中提供的试剂).
(4)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
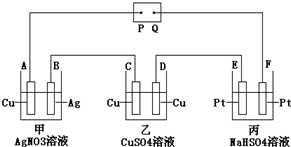
| A. | P是电源的正极 | |
| B. | F极上发生的反应为:4OH--4e-=2H2O+O2↑ | |
| C. | 电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参加了反应 | |
| D. | 通电后,甲池溶液的pH减小,乙池溶液的浓度增大、丙池溶液的pH不变 |
| A. | 可逆反应达到化学平衡状态时,正、逆反应速率均等于零 | |
| B. | 当反应物与生成物浓度相等时,可逆反应一定已达到化学平衡 | |
| C. | 化学反应的限度决定了反应物在该条件下的最大转化率 | |
| D. | 镀锌铁制品镀层受损后,铁制品比受损前更易生锈 |
| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | S(g)+O2(g)=SO2(g)放出热量大于297.23kJ | |
| B. | S(g)+O2(g)=SO2(g)放出热量小于297.23kJ | |
| C. | △H=-297.23kJ•mol-1表示固体S的燃烧热 | |
| D. | 形成1molSO2化学键释放的总能量大于断裂1molS(s)和1molO2(g)化学键吸收的总能量 |
 和
和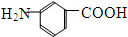 E、35Cl和37Cl
E、35Cl和37Cl