��Ŀ����
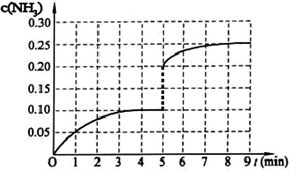
��10�֣���һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2(g)��3H2(g) 2NH3(g) ��H��0 ����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
2NH3(g) ��H��0 ����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
�Ÿ�����ͼ������ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ����v(NH3)=______________________________
�Ƹ÷�Ӧ450���ƽ�ⳣ��________500��ʱ��ƽ�ⳣ�����>������<����=������
��������������˵��������Ӧ�Ѵ�ƽ�����___________��
| A��3v����H2����2v����NH3�� |
| B�������������ƽ����Է���������ʱ����仯 |
| C��������������ܶȲ���ʱ����仯 |
| D������������ķ�����������ʱ����仯 |
�ɵ�5����ĩ�������������Сһ������ڵ�8����ĩ�ﵽ�µ�ƽ�⣨��ʱNH3Ũ��ԼΪ0.25mol/L����������ͼ�л�����5����ĩ����ƽ��ʱNH3Ũ�ȵı仯���ߡ�
��10�֣��� (2�֣�©д��λ��1�֣�
(2�֣�©д��λ��1�֣�
�� > ��2�֣� �� BD ��2�֣� �Ȳ���2�֣�
����ͼ��2�֣�
����

��12�֣�������һ�ֵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���塣��1����ͼ��1 mol NO2��1 mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ��д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ ��
��2����֪��N2(g)+ O2(g)=2 NO(g) ��H = ��180 kJ • mol-1
2NO(g)+2 CO(g)= N2(g) + 2 CO2(g) ��H = - 746 kJ • mol-1
��ӦCO(g) +![]() O2(g) = CO2(g)�ġ�H = kJ• mol-1
O2(g) = CO2(g)�ġ�H = kJ• mol-1
��3����һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0.2mol��N2��0.6 mol��H2����һ�������·������·�Ӧ�� N2(g)��3H2(g)![]() 2NH3(g) ��H ��0������5����ʱ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ0.2 mol��ƽ��ʱH2��ת����Ϊ ���÷�Ӧ��ƽ�ⳣ������ʽK = ��
2NH3(g) ��H ��0������5����ʱ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ0.2 mol��ƽ��ʱH2��ת����Ϊ ���÷�Ӧ��ƽ�ⳣ������ʽK = ��
(4) �ڹ̶�������ܱ������У�1.0��103 kPaʱ��Ӧ N2(g)+3H2(g) 2NH3(g)
2NH3(g)
��H<0 ��ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
| T/K | 298 | 398 | 498 |
| ƽ�ⳣ��K | 51 | K1 | K2 |
��K1 K2�������������=��������
�����и�����˵�������ϳɰ���Ӧһ���ﵽƽ��״̬���� ������ĸ��
a��������N2��H2��NH3��Ũ��֮��Ϊ1:3:2 b��NH3��Ũ�ȱ��ֲ���
c��������ѹǿ���ֲ��� d�����������ܶȱ��ֲ���
 ���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮
���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮 ��2013?�㶫ģ�⣩��һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2��g��+3H2��g��?2NH3��g����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
��2013?�㶫ģ�⣩��һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2��g��+3H2��g��?2NH3��g����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺