题目内容
一定温度下,向一个容积为2 L的真空密闭容器中通入1 mol N2和3 mol H2,3 min后,测得容器内的压强是开始时的0.9倍,则这段时间内v(H2)为
A.0.2 mol/(L·min) B.0.6 mol/(L·min) C.0.1 mol/(L·min)  D.0.3 mol/(L·min)
D.0.3 mol/(L·min)
练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
19.下列关于分散系的叙述不正确的是( )
| A. | 胶体区别于其它分散系的本质特征是分散质的微粒直径在10-9-10-7m之间 | |
| B. | FeCl3溶液是电中性的,Fe(OH)3胶体带正电荷 | |
| C. | 胶体的分散质能通过滤纸空隙 | |
| D. | 树林中晨曦的阳光光束现象与丁达尔现象有关 |
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
编号[ | H | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
(1)该反应的离子方程式为____________________________;
(2)探究温度对化学反应速率影响的实验编号是 ,探究反应物浓度对化 学反应速率影响的实验编号是 ;
学反应速率影响的实验编号是 ;
(3)实验①测得K MnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)= mol·L-1·min-1;
MnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)= mol·L-1·min-1;
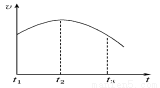
(4)该反应的速率v和时间t的关系如图所示,在t1~t2时段反应速率________(填“加快”或“减慢”或“变化不明显”),主要原因是_____________________。
2.科学家正在研究温室气体CH4和CO2的转化和利用.
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为H<C<O.
(2)下列关于CH4和CO2的说法正确的是ad(填序号).
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2.
①基态Ni原子的电子排布式为[Ar]3d84s2,该元素位于元素周期表中的第VIII族.
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有8mol σ键.
(4)一定条件下,CH4、CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”.

①“可燃冰”中分子间存在的2种作用力是氢键,范德华力.
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是二氧化碳的分子直径小于笼状结构的空腔直径,且二氧化碳与水的结合能力强于甲烷.
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为H<C<O.
(2)下列关于CH4和CO2的说法正确的是ad(填序号).
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2.
①基态Ni原子的电子排布式为[Ar]3d84s2,该元素位于元素周期表中的第VIII族.
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有8mol σ键.
(4)一定条件下,CH4、CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”.

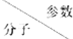 | 分子直径/nm | 分子与H2O的结合能E/kJ•mol-1 |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是二氧化碳的分子直径小于笼状结构的空腔直径,且二氧化碳与水的结合能力强于甲烷.


 2C2O4溶液[
2C2O4溶液[ 定条件下,用甲烷可以消除氮的氧化物(NOx)的污染,已知:
定条件下,用甲烷可以消除氮的氧化物(NOx)的污染,已知: H2(g)+Br2(g),下列四个图中可以表示该反应在一定条件下为可逆反应的是
H2(g)+Br2(g),下列四个图中可以表示该反应在一定条件下为可逆反应的是 B.
B. C.
C. D.
D.
 某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2•6C2H5OH.请回答下列问题:
某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2•6C2H5OH.请回答下列问题: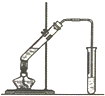 Ⅰ.乙烯是石油裂解气的主要成分,乙烯的结构简式为H2C=CH2.
Ⅰ.乙烯是石油裂解气的主要成分,乙烯的结构简式为H2C=CH2.