题目内容
4. 某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2•6C2H5OH.请回答下列问题:
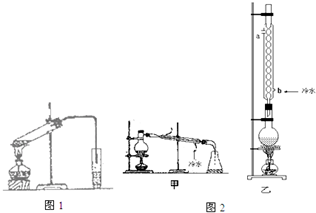
某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2•6C2H5OH.请回答下列问题:(1)制备乙酸乙酯装置如图所示,虚框内玻璃仪器名称为;冷凝水流经冷凝管时应从B口进入 (填“a”或“b”);
(2)生成乙酸乙酯的化学反应方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(3)下列措施可提高乙酸的转化率可采取的有AB
A.增加乙醇的用量 B.蒸出乙酸乙酯
C.增加乙酸的用量D.冷凝管中通热水
(4)实验所得乙酸乙酯远低于理论产量的可能原因.原料乙醇、乙酸未反应就被蒸出;发生其他副反应 (写出其中两种)
(5)为了除去粗产品其中的醋酸,可向产品中加入溶液,在分液漏斗中充分振荡,然后静置,待分层后(填选项)D.
A.直接将有机层从分液漏斗上口倒出
B.直接将有机层从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将有机层从下口放出
D.先将水层从分液漏斗的下口放出,再将有机层从上口倒出
(6)再向得到的有机物粗产品中加入饱和氯化钙溶液,振荡、分离.加入饱和氯化钙溶液的目的是除去乙醇.
(7)最后,加入干燥剂除去其中的水分,再进行蒸馏 (填操作),即可得到纯净的乙酸乙酯.
分析 (1)为充分冷凝,使蒸馏水充满冷凝管,则应从下端入;
(2)乙酸和乙醇之间反应生成乙酸乙酯和水;
(3)可提高乙酸的转化率的方法就是促使化学平衡正向移动的方法;
(4)原料乙醇、乙酸易挥发,可能未反应就被蒸出,并且会伴随副反应的发生;
(5)分液漏斗中下层液体从下面漏出,上层液体从上口倒出,据此回答;
(6)乙醇在饱和氯化钙溶液中的溶解度很小,可以用来除去乙醇;
(7)互溶液体的分离采用蒸馏法.
解答 解:(1)为充分冷凝,使蒸馏水充满冷凝管,则应从下端,即b进冷凝水,故答案为:b;
(2)乙酸和乙醇之间反应生成乙酸乙酯和水,即CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(3)可提高乙酸的转化率的方法就是促使化学平衡正向移动的方法,
A.增加乙醇的用量可以使平衡正向移动,故正确;
B.蒸出乙酸乙酯可以使平衡正向移动,故正确;
C.增加乙酸的用量乙酸的转化率降低,故错误;
D.冷凝管中通热水,乙酸的转化率降低,故错误;
故选AB;
(4)原料乙醇、乙酸未反应就被蒸出,发生其他副反应,导致实验所得乙酸乙酯远低于理论产量;
故答案为:原料乙醇、乙酸未反应就被蒸出;发生其他副反应;
(5)为了除去粗产品其中的醋酸,可向产品中加入饱和碳酸钠溶液,乙酸乙酯在上层,下层是无色溶液,下层液体从下面漏出,上层液体从上口倒出,先将水层从分液漏斗的下口放出,再将有机层从上口倒出,故选D.
故答案为:饱和碳酸钠溶液;D;
(6)乙醇在饱和氯化钙溶液中的溶解度很小,可以用此物质来除去乙醇,故答案为:除去乙醇;
(7)加入干燥剂除去其中的水分,整流后可得到纯净的乙酸乙酯,故答案为:蒸馏.
点评 本题考查了乙酸乙酯的制备,综合考查了物质的分离方法,冷凝,产量的分析等,难度适中,考查学生解决实际问题的能力.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 酸性氧化物:CO、NO2、SO3、H2O | |
| B. | 碱性氧化物:Na2O、CaO、Mn2O7、Na2O2 | |
| C. | 碱:NaOH、Cu2(OH)2CO3、Ba(OH)2、NH3•H2O | |
| D. | 酸:HN3、CH3COOH、H2S、H3PO2 |
 已知如表数据:
已知如表数据:| 物 质 | 2,4,6 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
请同学们回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是先加乙酸和乙醇各4mL,再缓缓加入1mL浓H2SO4,边加边振荡.
(2)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,浓H2SO4的作用是催化剂、吸水剂.
(3)步骤③中,用小火加热试管中的混合液,其原因与结论乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失.
(4)步骤④所观察到的现象是在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄,写出原因是上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是分液漏斗,产物应从上口倒出,因为乙酸乙酯比水密度小.
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如图2甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物).你认为乙装置合理,因为反应物能冷凝回流.
2NH3(g)+CO2(g)═NH2COONH4(s)△H<0
(1)如用下图I装置制取氨气,锥形瓶中可选择的试剂是氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰)等.
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中.当悬浮物较多时,停止制备.

注:CCl4与液体石蜡均为惰性介质.
①图I中滴加液体的仪器名称是分液漏斗,液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率),发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称),为了得到干燥产品,应采取的方法是b(填写选项序号).
a.常压加热烘干 b.减压40℃以下烘干 c.高压加热烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究,请填写表中空格.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置. | 溶液变浑浊,则证明固体中含有(NH4)2CO3. |
| 步骤3:取步骤2的上层清液于试管中加入少量的Ba(OH)2溶液. | 溶液不变浑浊,则证明固体中不含有NH4HCO3. |
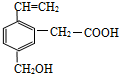 ,关于该有机物的叙述正确的是( )
,关于该有机物的叙述正确的是( )| A. | 不能跟NaOH溶液反应 | |
| B. | 能使溴的四氯化碳溶液褪色,1moL该物质因加成反应消耗溴2mol | |
| C. | 既能与乙酸发生酯化反应,又能与乙醇发生酯化反应 | |
| D. | 在足量的氧气中燃烧1mol该有机物生成H2O 7 mol |
 D.0.3 mol/(L·min)
D.0.3 mol/(L·min) Fe(SCN)3(血红色) +3KCl,向溶液中加入KCl固体可快速看到血红色
Fe(SCN)3(血红色) +3KCl,向溶液中加入KCl固体可快速看到血红色 2O与NH4Cl的反应是放热反应
2O与NH4Cl的反应是放热反应