题目内容
20.某无色水溶液中能大量共存的离子组是( )| A. | K+、Na+、CO32-、Cl- | B. | Ca2+、K+、CO32-、OH- | ||
| C. | Fe3+、Ba2+、NO3-、SO42- | D. | H+、Na+、Cu2+、NO3- |
分析 无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.四种离子之间不发生反应,都是无色离子;
B.钙离子与碳酸根离子、氢氧根离子反应;
C.铁离子为有色离子,钡离子与硫酸根离子反应生成硫酸钡沉淀;
D.铜离子为有色离子,不满足溶液无色的条件.
解答 解:无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.K+、Na+、CO32-、Cl-之间不反应,都是无色离子,在溶液中能够大量共存,故A正确;
B.Ca2+与CO32-、OH-之间发生反应,在溶液中不能大量共存,故B错误;
C.Fe3+为有色离子,Ba2+、SO42-之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故C错误;
D.Cu2+为有色离子,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在等.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
10.从海水中提取镁涉及到的化学反应有:①CaO+H2O=Ca(OH)2、②Mg2++2OH-=Mg(OH)2↓、③Mg(OH)2+2HCl=MgCl2+2H2O、④MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑没有涉及到的反应类型是( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
12.反应4NH3+5O2?4NO+6H2O,在2L的密闭容器中进行,半分钟后,NO的物质的量增加了0.1mol,则此反应的平均反应速率表示正确的是( )
| A. | v(NH3)=0.1mol•L-1•min-1 | B. | v(O2)=0.15mol•L-1•min-1 | ||
| C. | v(NO)=0.2mol•L-1•min-1 | D. | v(H2O)=0.25mol•L-1•min-1 |
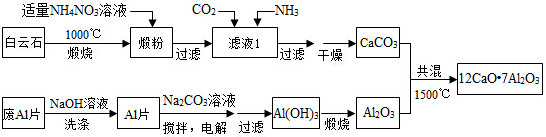
 .
.
 NH3•H2O+H+.
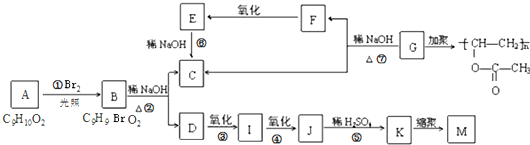
NH3•H2O+H+.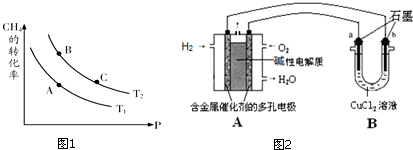
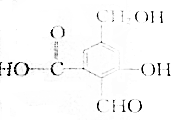 .
. .
.