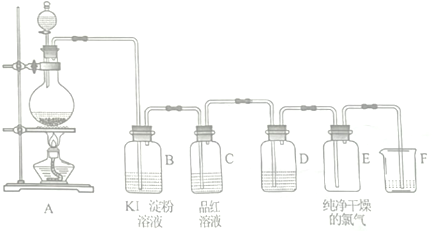
题目内容
15.2015年冬北京出现了两次严重雾霾,发布了“空气重污染红色预警”.其中大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等.(1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,则该溶液为酸性(填“酸性”或“碱性”)溶液,其原因用离子方程式解释是:NH4++H2O
 NH3•H2O+H+.
NH3•H2O+H+.(2)①“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有b、c(填代号)
a.CaCl2溶液 b.氨水 c.Ca(OH)2悬浊液 d.浓H2SO4
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,减少氮氧化物及一氧化碳的排放,已知下列热化学方程式:
Ⅰ.N2(g)+O2(g)?2NO(g)△H=+180.5kJ•mol-1
Ⅱ.2C(s)+O2(g)?2CO(g)△H=-221.0kJ•mol-1
Ⅲ.C(s)+O2(g)?CO2( g)△H=-393.5kJ•mol-1
写出一氧化氮与一氧化碳反应的热化学方程式2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol
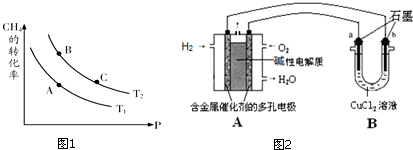
(3)开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,也可制作燃料电池.生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图.则Tl<T2(填“<”、“>”、“=”)
②100℃时,将1mol CH4和2mol H2O通入容积为1L的定容密闭容器中,发生反应,能说明该反应已经达到平衡状态的是cd
a.容器内气体密度恒定
b.单位时间内消耗0.1mol CH4同时生成0.3molH2
c.3v正(CH4)=v逆(H2)
d.容器中气体的分子总数不随时间而变化
(4)氢气燃料电池可以提升能量利用率.下图是利用氢气燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:
请回答:
①氢气燃料电池的负极反应式是H2+2OH--2e-=2H2O.
②当线路中有0.1mol电子通过时,b极增重3.2g
分析 (1)NH4+水解显酸性,PM2.5的酸碱性为酸性;
(2)①二氧化硫是酸性氧化物和碱或碱性盐溶液反应;
②根据盖斯定律,NO(g)和CO(g)反应生成N2(g)、CO2(g)的热化学方程式可由 ③×2-①-②得到;
(3)①正反应为吸热反应,压强一定时,升高温度,平衡向正反应方向移动,甲烷的转化率增大,据此判断温度大小;
②a.100℃时,反应混合物都是气体,混合气体总质量不变,容器的容积不变,容器内气体密度始终不变;
b.单位时间内消耗0.1mol CH4同时生成0.3molH2,反应始终按此比例进行;
c.3v正(CH4)=v逆(H2),不同物质的正逆速率之比等于化学计量数之比,反应到达平衡;
d.随反应进行混合气体总物质的量增大,如容器中气体的分子总数不随时间而变化,反应到达平衡;
(4)①负极发生氧化反应,氢气被氧化生成水;
②根据装置图可知,b电极与燃料电池的负极相连,作阴极,阴极析出铜,电极反应式是Cu2++2e-=Cu,质量增大,当线路中有0.1mol电子通过时,阴极析出0.05mol铜.
解答 解:(1)NH4+水解显酸性,离子方程式为:NH4++H2O?NH3•H2O+H+,故答案为:酸性;NH4++H2O NH3•H2O+H+;
NH3•H2O+H+;
(2)①二氧化硫是酸性氧化物和碱或碱性盐溶液反应,故答案为:b、c;
②ⅰN2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1-------①
ⅱ2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1--------②
ⅲC(s)+O2(g)═CO2( g)△H=-393.5kJ•mol-1--------③
由盖斯定律,NO(g)和CO(g)反应生成N2(g)、CO2(g)的热化学方程式可由③×2-①-②得到,即2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol,
故答案为:2NO(g)+2 CO (g)=N2(g)+2CO2(g)△H=-746.5kJ/mol;
(3)①由图开始,压强一定时,温度T2的转化率较大,正反应为吸热反应,升高温度,平衡向正反应方向移动,甲烷的转化率增大,故温度Tl<T2,故答案为:<;
②a.100℃时,反应混合物都是气体,混合气体总质量不变,容器的容积不变,容器内气体密度始终不变,不能说明得到平衡,故a错误;
b.单位时间内消耗0.1mol CH4同时生成0.3molH2,反应始终按此比例进行,不能说明到达平衡,故b错误;
c.3v正(CH4)=v逆(H2),不同物质的正逆速率之比等于化学计量数之比,反应到达平衡,故c正确;
d.随反应进行混合气体总物质的量增大,如容器中气体的分子总数不随时间而变化,反应到达平衡,故d正确,
故答案为:cd;
(4)①负极发生氧化反应,氢气被氧化生成水,电极方程式为H2+2OH--2e-=2H2O,故答案为:H2+2OH--2e-=2H2O;
②根据装置图可知,b电极与燃料电池的负极相连,作阴极.溶液中的铜离子在阴极放电,电极反应式是Cu2++2e-=Cu,所以b电极质量增加0.05mol×64g/mol=3.2g,故答案为:3.2.
点评 本题考查了盖斯定律求焓变、化学平衡影响因素,化学反应速率,平衡常数概念计算应用,原电池电解池原理的分析应用,注意平衡的条件分析,电极反应和电子守恒的计算是解题关键,题目难度中等.

| A. | MgSO4=Mg2++SO42- | B. | Ba(OH)2=Ba2++OH2- | ||
| C. | NaHCO3=Na++HCO3- | D. | H2SO4=2H++SO42- |
| 分类 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 盐酸 | NaCl溶液 | 硫酸 | 干冰 |
| B | 胆矾 | Fe(OH)3胶体 | 硫酸钡 | 乙醇 |
| C | 石墨 | 空气 | 苛性钾 | 碳酸钙 |
| D | 浓硫酸 | 氨水 | 氯化钠 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
| A. | 碳酸氢钠溶液中加入氢氧化钠反应:HCO3-+OH-=CO2↑+H2O | |
| B. | 用氯化铁溶液腐蚀铜电路板:2Fe3++Cu=2Fe2++Cu2+ | |
| C. | 用热浓盐酸洗涤试管壁上附着的MnO2:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| D. | 盛放氢氧化钠溶液的试剂瓶不能使用玻璃塞:SiO2+2OH-=SiO32-+H2O |
| A. | K+、Na+、CO32-、Cl- | B. | Ca2+、K+、CO32-、OH- | ||
| C. | Fe3+、Ba2+、NO3-、SO42- | D. | H+、Na+、Cu2+、NO3- |