题目内容
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2?xH2O).有如下操作:
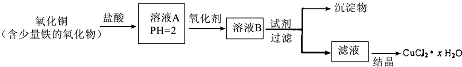
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解.
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+.不能检验溶液A中Fe3+的试剂为 (填编号,下同)
①KMnO4 ②(NH4)2S ③NaOH ④KSCN
(2)氧化剂可选用
①Cl2 ②KMnO4 ③HNO3 ④H2O2
(3)要得到较纯的产品,试剂可选用
①NaOH ②FeO ③CuO ④Cu(OH)2 ⑤Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是 (按实验先后顺序选填编号)
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
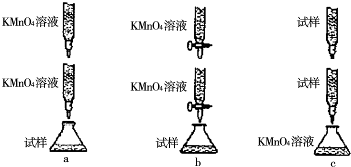
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需 ,下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)

已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解.
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+.不能检验溶液A中Fe3+的试剂为
①KMnO4 ②(NH4)2S ③NaOH ④KSCN
(2)氧化剂可选用
①Cl2 ②KMnO4 ③HNO3 ④H2O2
(3)要得到较纯的产品,试剂可选用
①NaOH ②FeO ③CuO ④Cu(OH)2 ⑤Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需

考点:制备实验方案的设计,铁的氧化物和氢氧化物,铜金属及其重要化合物的主要性质,探究物质的组成或测量物质的含量
专题:几种重要的金属及其化合物
分析:用含少量铁的氧化物的氧化铜加盐酸溶解生成氯化铜、氯化铁、氯化亚铁,加氧化剂把亚铁离子氧化为铁离子,再调节pH,铁离子转化为氢氧化铁沉淀,过滤得到的滤液为氯化铜溶液,蒸发浓缩、冷却结晶得到氯化铜晶体;
(1)铁离子具有氧化性性,与KSCN混合溶液变红色,与氢氧根离子结合生成红褐色沉淀;
(2)加入氧化剂,将Fe2+氧化为Fe3+,易除去,除杂时,不能引入新的杂质;
(3)在制取过程中,不能引进杂质离子,据此来选择合适的试剂;
(4)根据溶液获得晶体的方法来回答;
(5)根据配制一定物质的量浓度的KMnO4溶液所需仪器和高锰酸钾的性质来分析.
(1)铁离子具有氧化性性,与KSCN混合溶液变红色,与氢氧根离子结合生成红褐色沉淀;
(2)加入氧化剂,将Fe2+氧化为Fe3+,易除去,除杂时,不能引入新的杂质;
(3)在制取过程中,不能引进杂质离子,据此来选择合适的试剂;
(4)根据溶液获得晶体的方法来回答;
(5)根据配制一定物质的量浓度的KMnO4溶液所需仪器和高锰酸钾的性质来分析.
解答:
解:用含少量铁的氧化物的氧化铜加盐酸溶解生成氯化铜、氯化铁、氯化亚铁,加氧化剂把亚铁离子氧化为铁离子,再调节pH,铁离子转化为氢氧化铁沉淀,过滤得到的滤液为氯化铜溶液,蒸发浓缩、冷却结晶得到氯化铜晶体;
(1)铁离子具有氧化性性,能与S2-反应生成淡黄色沉淀S,铁离子与KSCN混合溶液变红色,铁离子与氢氧根离子结合生成红褐色沉淀,铁离子与高锰酸钾溶液不反应,所以只有高锰酸钾溶液不能检验铁离子,
故答案为:①;
(2)根据题意,加入氧化剂可把Fe2+氧化为Fe3+,而没有增加新杂质,所以氧化剂为H2O2或是Cl2,KMnO4和HNO3 会引入杂质离子;
故答案为:①④;
(3)得到较纯的产品,需要调节pH使铁离子转化为沉淀,选择的试剂可以是CuO、Cu(OH)2或Cu2(OH)2CO3,而①②均会引入杂质离子,
故答案为:③④⑤;
(4)从滤液经过结晶得到氯化铜晶体,首先要加热蒸发浓缩,冷却后,再将之过滤即可,故答案为:②④①;
(5)配制一定物质的量浓度的KMnO4溶液需要的仪器有:天平、玻璃棒、烧杯、胶头滴管、250mL容量瓶,高锰酸钾具有强氧化性,必须放在酸式滴定管中,
故答案为:250mL容量瓶;b.
(1)铁离子具有氧化性性,能与S2-反应生成淡黄色沉淀S,铁离子与KSCN混合溶液变红色,铁离子与氢氧根离子结合生成红褐色沉淀,铁离子与高锰酸钾溶液不反应,所以只有高锰酸钾溶液不能检验铁离子,
故答案为:①;
(2)根据题意,加入氧化剂可把Fe2+氧化为Fe3+,而没有增加新杂质,所以氧化剂为H2O2或是Cl2,KMnO4和HNO3 会引入杂质离子;
故答案为:①④;
(3)得到较纯的产品,需要调节pH使铁离子转化为沉淀,选择的试剂可以是CuO、Cu(OH)2或Cu2(OH)2CO3,而①②均会引入杂质离子,
故答案为:③④⑤;
(4)从滤液经过结晶得到氯化铜晶体,首先要加热蒸发浓缩,冷却后,再将之过滤即可,故答案为:②④①;
(5)配制一定物质的量浓度的KMnO4溶液需要的仪器有:天平、玻璃棒、烧杯、胶头滴管、250mL容量瓶,高锰酸钾具有强氧化性,必须放在酸式滴定管中,
故答案为:250mL容量瓶;b.
点评:本题考查了物质的制备方案设计,侧重于考查学生的阅读获取信息能力、对工艺流程理解与实验条件控制、实验方案的评价、物质分离提纯除杂等实验操作能力,题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.

练习册系列答案
相关题目
与22g二氧化碳所含氧原子数相等的水的质量是( )
| A、9g | B、22g |
| C、44 g | D、18g |
 反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述不正确的是
反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述不正确的是( )
| A、达到平衡后,加入催化剂,C%不变 |
| B、该反应为放热反应 |
| C、化学方程式中m+n>e+f |
| D、达到平衡后,增加A的质量有利于平衡向右移动 |
下列有关说法中正确的是( )
| A、硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B、可以用氢氧化铜悬浊液检验甘油和酒精 |
| C、通过化学变化可以实现16O与18O间的相互转化 |
| D、由金属元素和非金属元素形成的化学键一定是离子键 |
 (1)某研究性学习小组的同学将一置于空气中的铝片投入浓CuCl2溶液中,铝片表面出现一层暗红色物质,此后铝片上开始产生大量气泡,溶液温度迅速上升,暗红色物质表面有黑色固体生成.
(1)某研究性学习小组的同学将一置于空气中的铝片投入浓CuCl2溶液中,铝片表面出现一层暗红色物质,此后铝片上开始产生大量气泡,溶液温度迅速上升,暗红色物质表面有黑色固体生成.