题目内容
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ?mol-1
(1)该反应500℃时的平衡常数 450℃时的平衡常数(填“>”、“<”或“=”).
(2)判断该反应达到平衡状态的标志是 .(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d. v(O2)正=2v(SO3)逆
e.容器中混合气体的密度保持不变
(3)欲提高SO2的转化率,下列措施可行的是 .(填字母)
a.向装置中再充入N2 b.向装置中再充入O2c.改变反应的催化剂 d.升高温度
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO3 0.18mol;若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后, mol<n(SO3)< mol.
(1)该反应500℃时的平衡常数
(2)判断该反应达到平衡状态的标志是
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d. v(O2)正=2v(SO3)逆
e.容器中混合气体的密度保持不变
(3)欲提高SO2的转化率,下列措施可行的是
a.向装置中再充入N2 b.向装置中再充入O2c.改变反应的催化剂 d.升高温度
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO3 0.18mol;若继续通入0.20mol SO2和0.10mol O2,则平衡
考点:化学平衡的计算,化学平衡的影响因素,化学平衡状态的判断
专题:
分析:(1)平衡常数只与温度有关,吸热反应平衡常数随温度升高而增大,放热反应则相反;
(2)根据化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变来判断;
(3)提高SO2的转化率,依据影响化学平衡移动方向判断;
(4)根据影响化学平衡的因素来判断平衡移动方向,利用极限法求出再次达平衡后n(SO3)的范围.
(2)根据化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变来判断;
(3)提高SO2的转化率,依据影响化学平衡移动方向判断;
(4)根据影响化学平衡的因素来判断平衡移动方向,利用极限法求出再次达平衡后n(SO3)的范围.
解答:
解:(1)化学平衡常数只与温度有关,吸热反应平衡常数随温度升高而增大,放热反应平衡常数随温度升高而减小,该反应为放热反应,500℃时的平衡常数小于450℃时的平衡常数,故答案为:<;
(2)化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变来判断,
a.SO2和SO3浓度相等,但不能说明正逆反应速率相同,不能说明反应达到平衡状态,故a错误;
b.SO2百分含量保持不变,说明平衡混合物中各组成成分含量不变,反应达到平衡状态,故b正确;
c.反应前后气体物质的量变化,容器中气体压强不随时间而变化,说明气体物质的量不变,证明反应达到平衡状态,故c正确;
d.v正(O2)=2v逆(SO3),又v正(O2)=
v正(SO3),所以v逆(SO3)≠v正(SO3),不能判断是否达到平衡,故d错误;
故答案为:bc;
(3)a、恒温恒容通入与平衡无关的气体,总压增大,分压不变,平衡不动,二氧化硫转化率不变,故a错误;
b、增加氧气的量,反应物浓度增大,反应速率增大,会使平衡正向进行,提高了二氧化硫的转化率,故b正确;
c、催化剂只改变速率不改变平衡,不改变转化率,故c错误;
d、升高温度,可以使平衡逆向进行,二氧化硫转化率减小,故d错误;
故选b;
(4)当生成0.18molSO3时,继续通入0.20mol SO2和0.10mol O2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;
用极限法求出n(SO3)的范围,
假设平衡不移动,此时n(SO3)=0.18×2=0.36mol,
假设0.40molSO2完全生成SO3,根据反应方程式2SO2(g)+O2(g)?2SO3(g)可知,n(SO3)=0.4mol,
所以再次达到平衡时,0.36mol<n(SO3)<0.40mol.
故答案为:向正反应方向;0.36;0.40.
(2)化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变来判断,
a.SO2和SO3浓度相等,但不能说明正逆反应速率相同,不能说明反应达到平衡状态,故a错误;
b.SO2百分含量保持不变,说明平衡混合物中各组成成分含量不变,反应达到平衡状态,故b正确;
c.反应前后气体物质的量变化,容器中气体压强不随时间而变化,说明气体物质的量不变,证明反应达到平衡状态,故c正确;
d.v正(O2)=2v逆(SO3),又v正(O2)=
| 1 |
| 2 |
故答案为:bc;
(3)a、恒温恒容通入与平衡无关的气体,总压增大,分压不变,平衡不动,二氧化硫转化率不变,故a错误;
b、增加氧气的量,反应物浓度增大,反应速率增大,会使平衡正向进行,提高了二氧化硫的转化率,故b正确;
c、催化剂只改变速率不改变平衡,不改变转化率,故c错误;
d、升高温度,可以使平衡逆向进行,二氧化硫转化率减小,故d错误;
故选b;
(4)当生成0.18molSO3时,继续通入0.20mol SO2和0.10mol O2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;
用极限法求出n(SO3)的范围,
假设平衡不移动,此时n(SO3)=0.18×2=0.36mol,
假设0.40molSO2完全生成SO3,根据反应方程式2SO2(g)+O2(g)?2SO3(g)可知,n(SO3)=0.4mol,
所以再次达到平衡时,0.36mol<n(SO3)<0.40mol.
故答案为:向正反应方向;0.36;0.40.
点评:本题考查了化学平衡的计算、化学平衡的影响因素及化学平衡状态的判断等知识,题目难度中等,注意掌握化学平衡及其影响因素,明确化学反应速率的概念及计算方法,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
下列各组离子一定能在指定环境中大量共存的是( )
| A、在c(H+)=10-10mol/L的溶液中 Al3+、NH4+、Cl-、NO3- |
| B、使甲基橙呈红色的溶液 Fe3+、Na+、SO42-、NO3- |
| C、水电离出来的c(H+)=10-12mol/L的溶液 K+、HCO3-、Cl-、ClO- |
| D、含Al3+、CO32-、Na+、AlO2-的溶液 |
 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按如图所示关系相互转化,已知A金属为单质,C的焰色呈黄色.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按如图所示关系相互转化,已知A金属为单质,C的焰色呈黄色.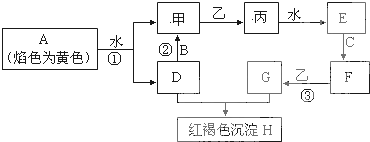
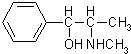 (1)药品分为处方药和非处方药.处方药是指必须在医生监控或指导下使用的药物,用符号
(1)药品分为处方药和非处方药.处方药是指必须在医生监控或指导下使用的药物,用符号