题目内容
5.37Cl原子核内的中子数与核外电子数之差为( )| A. | 3 | B. | 17 | C. | 20 | D. | 37 |
分析 根据原子符号的含义以及中子数=质量数-质子数,原子中核外电子数=核内质子数=原子序数,据此分析解答.
解答 解:37Cl原子核内的质子数是17,质量数是37,中子数=质量数-质子数=37-17=20,原子中核外电子数=核内质子数=17,核内的中子数与核外的电子数之差为20-17=3;
故选A.
点评 本题考查了原子的构成及其微粒间的关系,难度不大,注意基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列叙述正确的是( )
①热稳定性:H2O>HF>H2S
②泥水、淀粉溶液、盐酸分别属于悬浊液、胶体、溶液
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤第IA族元素铯的两种同位素137Cs比133Cs多4个质子
⑥已知2H2(g)+O2(g)=2H2O(l)△H=-571kJ•mol-1则氢气的燃烧热为△H=-285.5kJ•mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
①热稳定性:H2O>HF>H2S
②泥水、淀粉溶液、盐酸分别属于悬浊液、胶体、溶液
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤第IA族元素铯的两种同位素137Cs比133Cs多4个质子
⑥已知2H2(g)+O2(g)=2H2O(l)△H=-571kJ•mol-1则氢气的燃烧热为△H=-285.5kJ•mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
| A. | 只有②④⑥ | B. | 只有①⑤⑥ | C. | 只有②③④ | D. | 只有③⑤⑦ |
13.已知:
①1mol H2分子中化学键断裂时需要吸收436KJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
对于反应:H2(g)+Cl2(g)═2HCl(g),下列叙述正确的是( )
①1mol H2分子中化学键断裂时需要吸收436KJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
对于反应:H2(g)+Cl2(g)═2HCl(g),下列叙述正确的是( )
| A. | 反应生成2mol氯化氢气体,吸收248KJ的能量 | |
| B. | 反应生成2mol氯化氢气体,放出183KJ的能量 | |
| C. | 反应物的总能量低于生成物的总能量 | |
| D. | 该反应为吸热反应 |
20.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1.12L CCl4中含有C-Cl键数目为0.2NA | |
| B. | 标准状况下,2.24L氯气中含有${\;}_{17}^{35}$Cl数目一定为0.2NA | |
| C. | 常温常压下,4.4g CO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 80 mL 10 mol•L-1 盐酸与足量MnO2加热反应,产生Cl2的体积为4.48L |
10.100mL 6mol/L硫酸溶液与过量锌粉反应,在一定温度下,为了减缓反应速率但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 加入硫酸钠固体 | B. | 加入水 | ||
| C. | 加入100mL 1mol/L硫酸 | D. | 把锌粉换成锌粒 |
17.决定化学反应速率的主要因素是( )
| A. | 反应物本身的性质 | B. | 催化剂 | ||
| C. | 温度 | D. | 压强 |
15.二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料,其相关转化关系如图所示,下列说法正确的是( )


| A. | SiO2属于两性氧化物 | |
| B. | 盛放Na2CO3溶液的试剂瓶不能用玻璃塞 | |
| C. | 硅胶吸水后不能重复再生 | |
| D. | 图中所示转化反应都是氧化还原反应 |
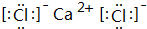 ;
; .
.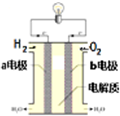 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.