题目内容
8.将21.9g铝铜合金完全溶于一定量的稀硝酸(假定硝酸的还原产物只有NO),向其中加入2mol/L NaOH溶液560mL时沉淀质量不再发生变化.将沉淀过滤、洗涤、干燥、灼烧后得24.0g黑色固体.试计算:(无计算过程不给分)(1)合金中铝的质量分数.
(2)反应中生成的NO气体在标准状况下的体积.
(3)溶解合金所用稀硝酸中含HNO3的物质的量.
分析 Al、Cu与硝酸发生氧化还原反应后,再与NaOH反应生成沉淀,将沉淀过滤、洗涤、干燥、灼烧后得24.0g黑色固体,可知黑色固体为CuO,结合Cu原子守恒可知Cu的质量,再由电子守恒或反应计算生成NO,由N原子守恒可计算硝酸的量,以此来解答.
解答 解:(1)灼烧后所得24.0 g黑色固体为CuO,原合金中含Cu 为24 g×$\frac{64}{80}$=19.2 g,合金中铝的质量分数为 $\frac{21.9g-19.2g}{21.9g}$×100%=12.3%,
答:合金中铝的质量分数为12.3%;
(2)设Al与稀HNO3反应生成NO的体积为V1,Cu与稀HNO3反应生成NO的体积为V2.
Al+4HNO3(稀)═Al(NO3)3+NO↑+2H2O
27 g 22.4L
2.7 g V1
V1═2.24 L
3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
3×64 g 2×22.4 L
19.2 g V2
V2═4.48 L
反应中生成的NO气体在标准状况下体积为2.24 L+4.48 L=6.72 L,
答:反应中生成的NO气体在标准状况下体积为6.72 L;
(3)根据反应前后钠元素守恒,加入的NaOH全部转化为NaAlO2和NaNO3.n(NaNO3)=n(NaOH)-n(NaAlO2)=2 mol/L×0.56 L-0.1 mol=1.02 mol,溶解合金时,有0.3 mol HNO3转化为NO,故溶解合金所用稀硝酸中含HNO3的物质的量为1.02 mol+0.3 mol=1.32 mol,
答:溶解合金所用硝酸中含HNO3的物质的量为1.32 mol.
点评 本题考查氧化还原的计算,为高频考点,把握发生的反应、原子或电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案①缩小体积 ②升高温度 ③通入CO2④增加碳的量 ⑤降低压强.
| A. | ①②③④ | B. | ②③④⑤ | C. | ①②③ | D. | ②③④ |
 (b)、
(b)、 (d)、
(d)、 (p)的说法正确的是( )
(p)的说法正确的是( )| A. | b、d和p是同分异构体 | |
| B. | b、d、p的二氯代物均只有三种 | |
| C. | b、d、p均可与酸性高锰酸钾溶液反应 | |
| D. | b、d、p中只有b的所有原子处于同一平面 |
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 苯(苯酚) | NaOH溶液 | 过滤 |
| C | 乙醇(乙酸) | CaO | 蒸馏 |
| D | 乙烷(乙烯) | 溴水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |

| A. | a和b都属于芳香族化合物 | |
| B. | a和c分子中所有碳原子均处于同一平面上 | |
| C. | a和b 均可以发生加成反应和氧化反应 | |
| D. | b和c互为同分异构体 |
| A. | pH=3的H2SO4和pH=11的氨水 | |
| B. | 0.1 mol/L的盐酸和0.2 mol/L的醋酸钠溶液 | |
| C. | 等物质的量浓度的盐酸和氨水 | |
| D. | 等物质的量浓度的硫酸和NaOH溶液 |
| A. | 共价化合物内部可能有离子键 | |
| B. | 原子或离子间相互吸引叫化学键 | |
| C. | 全部由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 第IA主族元素与第VIIA元素一定形成离子键 |
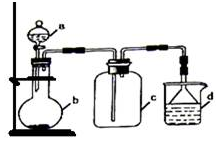 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 同质量、不同密度的N2和CO | B. | 同温度、同体积的N2和H2 | ||
| C. | 同体积、同密度的C2H4和CH4 | D. | 同压强、同体积的N2O和CO2 |