题目内容
大气中的SO2是造成酸雨的主要污染物,最新研究表明,离子晶体[N(CH3)4]2 SO4(s) 能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:[N(CH3)4]2 SO4(s)+SO2(g)?[N(CH3)4]2 S2O6(s)下列说法正确的是( )
| A、[N(CH3)4]+中只含共价键 |
| B、该反应中,SO2作氧化剂 |
| C、SO2漂白品红是利用其强氧化性 |
| D、每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2 S2O6 |
考点:氧化还原反应,共价键的形成及共价键的主要类型
专题:
分析:A.[N(CH3)4]+中含有配位键;
B.根据S元素的化合价变化判断;
C.二氧化硫没有强氧化性;
D.根据方程式计算.
B.根据S元素的化合价变化判断;
C.二氧化硫没有强氧化性;
D.根据方程式计算.
解答:
解:A.[N(CH3)4]+中含有配位键和共价键,故A错误;
B.:[N(CH3)4]2 SO4(s)+SO2(g)?[N(CH3)4]2 S2O6(s)反应中SO2中硫元素的化合价升高,SO2作还原剂,故B错误;
C.二氧化硫没有强氧化性,SO2漂白品红是与品红结合生成无色物质,故C错误;
D.[N(CH3)4]2 SO4(s)+SO2(g)?[N(CH3)4]2 S2O6(s)反应中消耗标准状况下的SO211.2L,即0.5mol,生成[N(CH3)4]2 S2O60.5mol,其质量为15.4g,故D正确.
故选D.
B.:[N(CH3)4]2 SO4(s)+SO2(g)?[N(CH3)4]2 S2O6(s)反应中SO2中硫元素的化合价升高,SO2作还原剂,故B错误;
C.二氧化硫没有强氧化性,SO2漂白品红是与品红结合生成无色物质,故C错误;
D.[N(CH3)4]2 SO4(s)+SO2(g)?[N(CH3)4]2 S2O6(s)反应中消耗标准状况下的SO211.2L,即0.5mol,生成[N(CH3)4]2 S2O60.5mol,其质量为15.4g,故D正确.
故选D.
点评:本题考查了化学键、氧化还原反应、二氧化硫的性质、根据方程式的计算等,题目涉及的知识点较多,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
分子式为C3H4FCl的所有可能的同分异构体(不考虑立体异构)数目为( )
| A、8 | B、9 | C、10 | D、11 |
下列热化学方程式中的△H能表示可燃物的燃烧热的是( )
| A、2H2S(g)+O2(g)=2S (s)+2H2O(l)△H=-Q2 kJ/mol | ||
| B、CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ/mol | ||
C、CO(g)+
| ||
| D、2H2(g)+O2(g)═2H2O(1);△H=-571.6kJ/mol |
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9,单质Y可与NaOH溶液反应生成氢气.下列说法不正确的是( )
| A、原子半径:Y>Z>W |
| B、XW2熔点为107℃,沸点为142.5℃,说明固态XW2为分子晶体 |
| C、电解YW3固体可得单质Y |
D、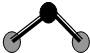 ZW2分子结构见右图,说明ZW2是极性分子 |
剧毒的氰化物可与碱发生反应2CN-+8OH-+5C12═2CO2+N2+10C1-+4H2O下列判断正确的是( )
| A、当有0.2 mol CO2生成时,溶液中阴离子的物质的量增加l mol |
| B、该反应中,每有2mol CN-反应,转移电子为10 mol |
| C、上述反应中的还原剂是OH- |
| D、还原性:Cl->CN- |