题目内容
7.下列叙述正确的有( )| A. | 第四周期元素中,锰原子价电子层中未成对电子数最多 | |
| B. | 第二周期主族元素的原子半径随核电荷数增大依次减小 | |
| C. | 卤素氢化物中,HCl的沸点最低的原因是其分子间的范德华力最小 | |
| D. | 价层电子对相斥理论中,π键电子对数不计入中心原子的价层电子对数 |
分析 A、第四周期元素中,外围电子排布为ndxnsy,且能级处于半满稳定状态时,含有的未成对电子数最多;
B、同周期核电荷数越多半径越小;
C、HF分子间存在氢键;
D、价层电子对相斥理论中,σ键和孤对电子对计入中心原子的价层电子对数,而π不计入.
解答 解:A、第四周期元素中,外围电子排布为ndxnsy,且能级处于半满稳定状态时,含有的未成对电子数最多,即外围电子排布为3d54s1,此元素为铬,故A错误;
B、同周期核电荷数越多半径越小,所以第二周期主族元素的原子半径随核电荷数增大依次减小,故B正确;
C、HF分子间存在氢键,HCl分子内没有氢键,故C错误;
D、价层电子对相斥理论中,σ键和孤对电子对计入中心原子的价层电子对数,而π不计入,故D正确;
故选BD.
点评 本题考查核外电子排布规律、元素周期律、氢键和价层电子对理论等,难度不大,注意选A在理解核外电子排布规律,注意能级处于全满、半满、全空时的稳定状态.

练习册系列答案
相关题目
18.下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法,正确的一组为( )
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| A | C2H5Br | C2H5OH | 用水洗涤、分液 |
| B | FeCl3 | CaCO3 | 溶解、过滤、蒸发结晶 |
| C | Al2(SO4)3溶液 | MgSO4 | 加入过量烧碱后过滤,再用硫酸酸化滤液 |
| D | CO2 | SO2 | 通过盛有品红溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
15.下列有关实验操作的叙述错误的是( )
| A. | 过滤操作中,漏斗的尖端应接触烧杯内壁 | |
| B. | 从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁 | |
| C. | 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 | |
| D. | 向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁 |
2.在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品.用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
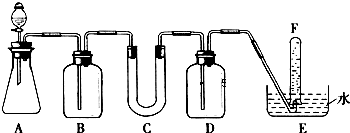
(1)A是利用盐酸和石灰石制取CO2的装置,A中发生反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)填写表中空格:
(3)写出过氧化钠与二氧化碳反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
在此反应中,过氧化钠的作用是③(填序号) ①氧化剂;②还原剂;③既是氧化剂又是还原剂;④既不是氧化剂,又不是还原剂.
(4)试管F中收集满气体后,下一步实验操作是:把E中的导管移出水面,关闭分液漏斗的活塞,用拇指堵住试管口,取出试管,立即用带火星的木条伸到试管F的管口,如果木条复燃,说明过氧化钠与二氧化碳反应产生氧气,可做供氧剂.

(1)A是利用盐酸和石灰石制取CO2的装置,A中发生反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
在此反应中,过氧化钠的作用是③(填序号) ①氧化剂;②还原剂;③既是氧化剂又是还原剂;④既不是氧化剂,又不是还原剂.
(4)试管F中收集满气体后,下一步实验操作是:把E中的导管移出水面,关闭分液漏斗的活塞,用拇指堵住试管口,取出试管,立即用带火星的木条伸到试管F的管口,如果木条复燃,说明过氧化钠与二氧化碳反应产生氧气,可做供氧剂.
9.下列溶液中有关物质的浓度关系正确的是( )
| A. | Na2C2O4溶液中,2c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4) | |
| B. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 等体积等物质的量浓度的NaCl和NaClO溶液,两份溶液中离子总数相比前者大 | |
| D. | 0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
7.人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.
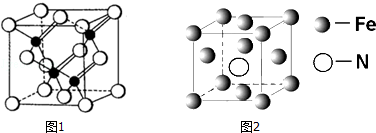
(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为8,基态铁原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d5.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式SO3等.
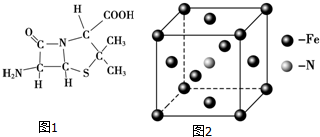
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.
(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(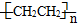 )分子中有5n个σ键
)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60gSiO2放出的能量为(2c-a-b) kJ
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该反应的化学方程式8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2,若两个最近的Fe原子间的距离为s cm,则该晶体的密度是$\frac{119\sqrt{2}}{2{s}^{3}{N}_{A}}$g•cm-3.
(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为8,基态铁原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d5.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式SO3等.
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.

(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(
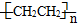 )分子中有5n个σ键
)分子中有5n个σ键d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60gSiO2放出的能量为(2c-a-b) kJ
| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |

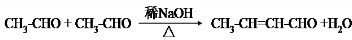 ,F 到 G 的反应类型加成反应或还原反应
,F 到 G 的反应类型加成反应或还原反应 ,姜黄素的结构简式
,姜黄素的结构简式
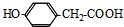 .
.