题目内容
某实验室利用氯化铵和足量的熟石灰反应制取4480mL 氨气(标准状况下),并将其通入水中配成100mL 溶液.
(1)请写出用氯化铵和足量的熟石灰反应制取氨气的化学方程式.
(2)计算实验中至少需要称取氯化铵的质量(用托盘天平称取).
(3)计算氨水中NH3的物质的量浓度(不考虑NH3与H2O的反应).
(1)请写出用氯化铵和足量的熟石灰反应制取氨气的化学方程式.
(2)计算实验中至少需要称取氯化铵的质量(用托盘天平称取).
(3)计算氨水中NH3的物质的量浓度(不考虑NH3与H2O的反应).
考点:氨的实验室制法,化学方程式的有关计算
专题:氮族元素
分析:(1)氯化铵和足量的熟石灰反应制取氨气的化学方程式为:2NH4C1+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)根据2NH4C1+Ca(OH)2
CaCl2+2NH3↑+2H2O计算需要氯化铵的质量;
(3)根据n=
计算氨气的物质的量,再根据c=
计算.
| ||
(2)根据2NH4C1+Ca(OH)2
| ||
(3)根据n=
| V |
| Vm |
| n |
| V |
解答:
解:(1)氯化铵和足量的熟石灰反应制取氨气的化学方程式为:2NH4C1+Ca(OH)2
CaCl2+2NH3↑+2H2O,答:氯化铵和足量的熟石灰反应制取氨气的化学方程式为:2NH4C1+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)设产生4480mL 氨气需要氯化铵的质量为m,则:
2NH4C1+Ca(OH)2
CaCl2+2NH3↑+2H2O
107g 44.8L
m 4.48L
故m=
=10.7g,
答:至少需称取氯化铵的质量是10.7g;
(3)4480mL (标准状况)氨气溶于水配成100mL溶液,c(NH3)=
=2 mol?L-1,
答:水中NH3的物质的量浓度是2 mol?L-1.
| ||
| ||
(2)设产生4480mL 氨气需要氯化铵的质量为m,则:
2NH4C1+Ca(OH)2
| ||
107g 44.8L
m 4.48L
故m=
| 107g×4.48L |
| 44.8L |
答:至少需称取氯化铵的质量是10.7g;
(3)4480mL (标准状况)氨气溶于水配成100mL溶液,c(NH3)=
| ||
| 0.1L |
答:水中NH3的物质的量浓度是2 mol?L-1.
点评:本题考查化学方程式计算、物质的量浓度计算,比较基础,侧重对基础知识的巩固,注意氨水中溶质为氨气.

练习册系列答案
相关题目
能用排水法收集的气体是( )
| A、CO2 |
| B、H2 |
| C、HCl |
| D、NH3 |
下列各组溶液,只要用试管和胶头滴管,不用任何化学试剂就可以鉴别的一组是( )
| A、KOH和Al2(SO4)3 |
| B、H2SO4和Na2CO3 |
| C、CaCl2和Na2CO3 |
| D、Ba(OH)2和NaHSO4 |
下列有关说法正确的是( )
| A、因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B、常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 |
| C、在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 |
| D、加热0.1mol?L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强 |
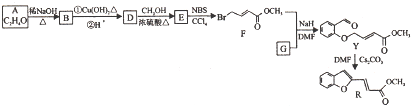
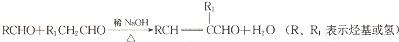
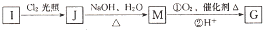
 互为同系物.
互为同系物. 元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.
元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.
