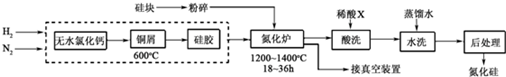
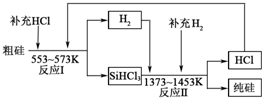
题目内容
11.1828年,德国化学家将一种无机物直接转变成有机化合物-尿素,由此打破了无机化合物与有机化合物的界限,尿素的化学式是( )| A. | CO(NH2)2 | B. | (NH4)2CO3 | C. | NH4NO3 | D. | CH3COONH4 |
分析 1828年德国化学家维勒用无机物合成了尿素,突破了无机物与有机物的界限,尿素的化学式为CO(NH2)2.
解答 解:1828年,德国化学家弗里德里希维勒首次用无机物质氰酸氨(一种无机化合物,可由氯化铵和氯酸银反应制得)与硫酸铵人工合成了尿素,尿素的化学式为CO(NH2)2.故选A.
点评 本题主要考查了化学史,难度不大,平时注意相关知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列有关实验的描述正确的是( )
| A. | 常温下,用pH计测定0.1mol/L的甲酸钠溶液pH为13 | |
| B. | 向饱和醋酸钠溶液中添加0.1mol/L的碳酸钠溶液产生了无色气体 | |
| C. | 少量Mg(OH)2沉淀中加入氯化铵浓溶液可以观其察到白色沉淀溶解 | |
| D. | 向2ml 1mol/L的NaOH溶液中加入3滴 1mol/L MgCl2溶液,再加入3 滴1mol/L FeCl3溶液可以证明Mg(OH)2沉淀转变成Fe(OH)3沉淀 |
2.下表是五种主族元素的结构特点及其元素、单质、化合物的性质.
(1)写出X元素的原子核外电子排布1s22s22p3;其单质的化学性质稳定(填“稳定”或“活泼”),该元素的非金属性强(填“强”或“弱”),证明其强弱的理由是硝酸是强酸.
(2)Z单质在空气中燃烧生成黄色粉末,写出该物质的电子式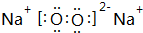 ;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.
;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.
(3)W的最高价氧化物对应水化物可以与X、Z的最高价氧化物对应水化物反应,写出反 应的离子方程式:Al(OH)3+3H+=Al3++3H2O,Al(OH)3+OH-=AlO2-+2H2O.
(4)一种元素有多种可变价态,一般高价氧化物对应水化物成酸,低价氧化物对应水化物成碱.Y、T可形成多种化合物,其中T元素的化合价为+3、+5时,形成的化合物的化学式为AB.
A.T2Y4 B.T4Y9 C.T6Y10 D.T2Y3.
| 元素 | 结构特点及元素、单质、化合物的性质 |
| X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
| Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
| Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
| W | 最外层电子排布(n+1)sn(n+1)pn-1 |
| T | 单质升华可以产生紫色的烟 |
(2)Z单质在空气中燃烧生成黄色粉末,写出该物质的电子式
 ;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.
;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.(3)W的最高价氧化物对应水化物可以与X、Z的最高价氧化物对应水化物反应,写出反 应的离子方程式:Al(OH)3+3H+=Al3++3H2O,Al(OH)3+OH-=AlO2-+2H2O.
(4)一种元素有多种可变价态,一般高价氧化物对应水化物成酸,低价氧化物对应水化物成碱.Y、T可形成多种化合物,其中T元素的化合价为+3、+5时,形成的化合物的化学式为AB.
A.T2Y4 B.T4Y9 C.T6Y10 D.T2Y3.
19.某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生且溶液不变蓝,下列叙述正确的是( )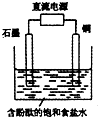

| A. | 铜电极上发生还原反应 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 溶液中的Na+向石墨电极移动 | D. | 铜电极附近观察到黄绿色气体 |
16.下列数量的各物质中,含原子个数最多的是( )
| A. | 1molHCl | B. | 3.01×1023个O2 | C. | 12g12C | D. | 0.5molCH4 |
3.设为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,15g甲基(-CH3)所含的中子数为6NA | |
| B. | 一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO32-)=1mol/L,则Na+个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的浓度为1mol/L |
1.在碱性溶液中,能大量共存的离子是( )
| A. | Mg2+、Fe3+、NO3-、K+ | B. | Al3+、Na+、Cl-、SO42- | ||
| C. | Na+、Ba2+、NO3-、Cl- | D. | K+、Na+、Cl-、HCO3- |