题目内容
15.下列说法或表达正确的是( )| A. | H2SO4的摩尔质量是98 | |
| B. | 通电时,溶液中的溶质分子分别向两极移动,胶体中的分散质粒子向某一极移动 | |
| C. | 丁达尔效应可用于区别溶液和胶体,云、雾均能产生丁达尔效应 | |
| D. | 将98gH2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol/L |
分析 A.摩尔质量的单位为g/mol;
B.通电时溶质电离出的阴阳离子分别移向两极,溶质是非电解质时不移向任何电极;
C.胶体具有丁达尔效应,云、雾都属于胶体;
D.98gH2SO4溶解于500mL水中,所得溶液体积不是500mL.
解答 解:A.H2SO4的摩尔质量是98g/mol,98为硫酸的相对分子质量,故A错误;
B.通电时,溶液中的溶质粒子是电解质,电离出的阴阳离子分别向两极移动,若溶质是非电解质不移向电极,胶体中的分散质粒子向某一极移动,故B错误;
C.胶体用一速光照射会有光亮的通路,所以可以区别溶液与胶体,云、雾是气溶胶,故C正确;
D.98gH2SO4溶解于500mL水中,硫酸的物质的量为1mol,而所得溶液的体积不是500mL,所以溶液浓度不是2mol/L,故D错误;
故选C.
点评 本题考查较为综合,涉及物质的量浓度的计算、胶体性质、摩尔质量与相对分子质量的关系等知识,题目难度不大,明确胶体的性质为解答关键,注意掌握物质的量与物质的量浓度、摩尔质量与相对分子质量之间的关系.

练习册系列答案
相关题目
5.如图为农夫山泉矿泉水瓶上的部分说明文字,列出了饮用天然水理化指标,这里的钙、钾、钠是指( )

| A. | 原子 | B. | 分子 | C. | 单质 | D. | 元素 |
10.二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用.回答下列问题:
(1)实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3).
①盐酸和NaClO3反应时有ClO2和Cl2生成,反应的离子方程式为2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O,当反应中转移0.2mol 电子时,参加反应的还原剂的物质的量为0.2mol.
②使用双氧水作还原剂的优点是使用双氧水作还原剂时氧化产物为氧气,对环境无污染.
(2)ClO2可用于合成亚氯酸钠(NaClO2).将ClO2通入NaOH溶液中,并加入适量双氧水,在稳定装置中充分反应可制得NaClO2成品. 已知:当pH≤2.0时,NaClO2能被I-完全还原成Cl-;二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用.回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
①步骤2发生反应的离子方程式为ClO2-+4H++4I-=2I2+Cl-+2H2O,滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化,加入指示剂的名称是淀粉溶液.
②若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为$\frac{9.05×10{\;}^{-2}VC}{4W}$×100%(用含w、c、V的代数式表示).
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含相同量CN-的电镀废水,所需Cl2的物质的量是ClO2的2.5倍.
(1)实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3).
①盐酸和NaClO3反应时有ClO2和Cl2生成,反应的离子方程式为2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O,当反应中转移0.2mol 电子时,参加反应的还原剂的物质的量为0.2mol.
②使用双氧水作还原剂的优点是使用双氧水作还原剂时氧化产物为氧气,对环境无污染.
(2)ClO2可用于合成亚氯酸钠(NaClO2).将ClO2通入NaOH溶液中,并加入适量双氧水,在稳定装置中充分反应可制得NaClO2成品. 已知:当pH≤2.0时,NaClO2能被I-完全还原成Cl-;二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用.回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
②若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为$\frac{9.05×10{\;}^{-2}VC}{4W}$×100%(用含w、c、V的代数式表示).
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含相同量CN-的电镀废水,所需Cl2的物质的量是ClO2的2.5倍.
7. 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )| A | B | C | D | |
| X | CO2 | HCl | NaOH | AlCl3 |
| Y | Ca(OH)2 | AlO2- | AlCl3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
3.氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如右图所示,回答以下问题:
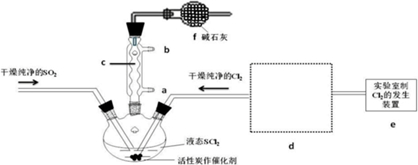
(1)仪器c的名称是球形冷凝管,装置f的作用是吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解
(2)实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(3)SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3•6H2O混合加热,可得到无水AlCl3,试解释原因:AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解
(4)下列四种制备SO2的方案中最佳选择是丁
(5)装置e中产生的Cl2经过d后进入三颈烧瓶,请在d的虚线框内画出所需实验装置图,并标出试剂.
(6)试验结束后,将三颈烧瓶中混合物分离开的实验操作是蒸馏
(已知SCl2的沸点为50℃)若反应中消耗的Cl2的体积为896ml(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为50%(保留三位有效数字).
(7)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,检验溶液w中存在的Cl-的方法是取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置,取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-.

(1)仪器c的名称是球形冷凝管,装置f的作用是吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解
(2)实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(3)SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3•6H2O混合加热,可得到无水AlCl3,试解释原因:AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解
(4)下列四种制备SO2的方案中最佳选择是丁
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 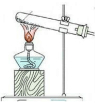 |  |  |  |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
(6)试验结束后,将三颈烧瓶中混合物分离开的实验操作是蒸馏
(已知SCl2的沸点为50℃)若反应中消耗的Cl2的体积为896ml(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为50%(保留三位有效数字).
(7)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,检验溶液w中存在的Cl-的方法是取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置,取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-.
4.电子工业中,常用氯化铁溶液作为印刷电路铜板蚀刻液.请按要求回答下列问题:
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓,该过程中调节溶液的pH为5,则c(Fe3+)为:4.0×10-11mol•L-1.(己知:Ksp[Fe(OH)3]=4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:
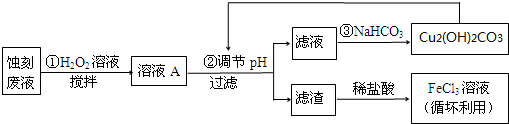
①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:Fe3+、Fe2+和Cu2+.
②FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:抑制氯化铁水解.
③步骤①中加入H2O2溶液的目的是:因为将Fe2+氧化成Fe3+,方便后续沉淀时除去.
④已知:生成氢氧化物沉淀的pH
根据表中数据推测调节pH的范围是:[3.2,4.7)或3.2≤pH<4.7.
⑤写出步骤②中生成CO2的离子方程式:4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑(已知Cu2(OH)2CO3难溶于水)
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓,该过程中调节溶液的pH为5,则c(Fe3+)为:4.0×10-11mol•L-1.(己知:Ksp[Fe(OH)3]=4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:

①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:Fe3+、Fe2+和Cu2+.
②FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:抑制氯化铁水解.
③步骤①中加入H2O2溶液的目的是:因为将Fe2+氧化成Fe3+,方便后续沉淀时除去.
④已知:生成氢氧化物沉淀的pH
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
⑤写出步骤②中生成CO2的离子方程式:4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑(已知Cu2(OH)2CO3难溶于水)
 .
.