题目内容
用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式.
(1)BaCl2(HCl)试剂 ,离子方程式: .
(2)O2(Cl2)试剂 ,离子方程式: .
(3)O2(CO2)试剂 ,离子方程式: .
(4)SO42-(CO32-)试剂 ,离子方程式: .
(1)BaCl2(HCl)试剂
(2)O2(Cl2)试剂
(3)O2(CO2)试剂
(4)SO42-(CO32-)试剂
考点:物质的分离、提纯和除杂,离子方程式的书写
专题:
分析:(1)可选用BaCO3除去HCl;
(2)氯气溶于氢氧化钠生成盐和水,氧气不溶于水,可选用氢氧化钠除去;
(3)二氧化碳是酸性气体,可选用强碱除去;
(4)硫酸的酸性比碳酸强,可选用硫酸除去碳酸根离子.
(2)氯气溶于氢氧化钠生成盐和水,氧气不溶于水,可选用氢氧化钠除去;
(3)二氧化碳是酸性气体,可选用强碱除去;
(4)硫酸的酸性比碳酸强,可选用硫酸除去碳酸根离子.
解答:
解:(1)除杂不能引入新的杂质,故可选用BaCO3除去HCl,离子方程式为:BaCO3+2H+═Ba2++H2O+CO2↑,故答案为:BaCO3;BaCO3+2H+═Ba2++H2O+CO2↑;
(2)氯气溶于氢氧化钠生成盐和水,氧气不溶于水,故选择试剂NaOH溶液,反应的离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:NaOH溶液;Cl2+2OH-=Cl-+ClO-+H2O;
(3)二氧化碳是酸性气体,可选用NaOH溶液除去;离子方程式为:2OH-+CO2═CO32-+H2O,故答案为:NaOH溶液;2OH-+CO2═CO32-+H2O;
(4)硫酸的酸性比碳酸强,可选用稀硫酸除去碳酸根离子,离子方程式为:CO32-+2H+═H2O+CO2↑,故答案为:稀硫酸;CO32-+2H+═H2O+CO2↑.
(2)氯气溶于氢氧化钠生成盐和水,氧气不溶于水,故选择试剂NaOH溶液,反应的离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:NaOH溶液;Cl2+2OH-=Cl-+ClO-+H2O;
(3)二氧化碳是酸性气体,可选用NaOH溶液除去;离子方程式为:2OH-+CO2═CO32-+H2O,故答案为:NaOH溶液;2OH-+CO2═CO32-+H2O;
(4)硫酸的酸性比碳酸强,可选用稀硫酸除去碳酸根离子,离子方程式为:CO32-+2H+═H2O+CO2↑,故答案为:稀硫酸;CO32-+2H+═H2O+CO2↑.
点评:本题主要考查的是除杂与离子反应方程式的书写,离子方程式的书写是高考不变的一个题型,每年高考必考,是热点题型,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
12ml0.1mol/L的亚硫酸(H2SO3)溶液,恰好跟20ml浓度为0.02mol/L的重铬酸钾(K2Cr2O7)溶液完全反应,则元素铬(Cr)在还原产物中的化合价是( )
| A、+1 | B、+2 | C、+3 | D、+6 |
向装有乙醇的烧杯中投入一小块金属钠,下列对该实验现象的描述,不正确的是( )
| A、钠块沉在乙醇液面的下面 |
| B、反应较为和缓 |
| C、钠块在乙醇的液面上游动 |
| D、钠块表面有气体放出 |
在实验中手不慎被玻璃划破,可用FeCl3溶液应急止血,其主要原因可能是( )
| A、FeCl3溶液有杀菌消毒作用 |
| B、FeCl3溶液能使血液聚集沉降 |
| C、FeCl3溶液能产生Fe(OH)3沉淀堵住伤口 |
| D、FeCl3能使血液发生化学反应 |
有机物A和B,由C、H、O中的两种或三种元素组成,相同物质的量的A和B完全燃烧时,消耗氧气的物质的量相等,下列对A、B的判断一定错误的是( )
| A、A与B互为同分异构体 |
| B、A与B的分子组成相差n个“CH2” |
| C、A与B的分子组成相差n个“CO2” |
| D、A与B的分子组成相差n个“H2O” |
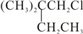 .B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示.
.B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示.