题目内容
4.用NA表示阿佛加德罗常数的数值,下列判断正确的是( )| A. | 标准状况下,8.0gSO3体积为2.24L | |
| B. | 物质的量为1molSO2、CO2的混合物所含氧原子数为2NA | |
| C. | 0.1molFeCl3溶液中含有的Fe3+数为0.1NA | |
| D. | 0.5mol镁在空气中完全燃烧所需要的氧气的物质的量为0.25mol |
分析 A.标准状况下,三氧化硫的状态不是气态;
B.二氧化硫和二氧化碳分子中都含有2个氧原子,1mol该混合气体中含有2molO
C.铁离子在溶液中部分水解,导致铁离子数目减少;
D.Mg能够与空气中氧气、氮气反应.
解答 解:A.标准状况下SO3不是气体,不能使用保证装置可向的去贴膜体积计算,故A错误;
B.1molSO2、CO2的混合物中含有2molO,所含氧原子数为2NA,故B正确;
C.铁离子发生水解,则溶液中含有的Fe3+数小于0.1NA,故C错误;
D.Mg能够与空气中的氧气、氮气反应,则0.5mol镁在空气中完全燃烧所需要的氧气的物质的量小于0.25mol,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的计算与判断,题目难度不大,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标准状况下气体摩尔体积的使用条件,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
16.托卡朋是基于2012年诺贝尔化学奖研究成果开发的治疗帕金森氏病的药物,其部分合成路线如图
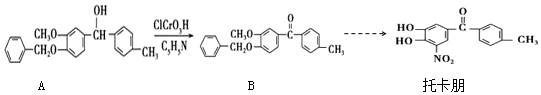
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 托卡朋的分子式为C14H11NO5 | |
| B. | 反应A→B的类型属于取代反应 | |
| C. | 托卡朋分子中所有的碳原子有可能在同平面内 | |
| D. | 托卡朋能发生加成反应 |
15.在含有Cl-、Na+、Br-、CO32-的溶液中加入过量的硝酸银溶液,产生沉淀后,加入过量稀硝酸,沉淀部分溶解,并有气泡放出,描述述现象的离子方程式错误的是( )
| A. | Ag++Cl-→AgCl↓ | B. | Ag++Br-→AgBr↓ | ||
| C. | Ag++CO32-→AgCO3↓ | D. | Ag2CO3+2H+→2Ag++CO2↑+H2O |
19.下列各组物质在适宜的条件下反应,其中氧化剂与还原剂物质的量之比为1:2的是( )
| A. | H2SO4(浓)+C | B. | Fe3O4+Al | C. | Cl2+Mg | D. | NO2+H2O |
13.能用键能大小解释的事实是( )
| A. | 稀有气体化学性质很稳定 | B. | 硝酸易挥发,而硫酸难挥发 | ||
| C. | 氮气的化学性质比氧气稳定 | D. | 常温常压下,溴呈液态,碘呈固态 |
2.( )和下列离子方程式相对应的化学方程式正确的是.
| A. | Zn2++2OH-=Zn(OH)2↓ ZnCO3+2NaOH=Zn(OH)2↓+Na2CO3 | |
| B. | Ba2++SO42-=BaSO4↓ Ba(OH)2+H2SO4=BaSO4↓+2H2O | |
| C. | Ag++Cl-=AgCl↓ AgNO3+KCl=AgCl↓+KNO3 | |
| D. | Cu+2Ag+=Cu2++2Ag↓ Cu+2AgCl=2Ag+CuCl2 |
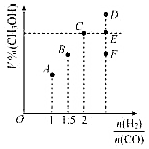 在工业上常用CO和H2合成甲醇,反应方程式为:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol.
在工业上常用CO和H2合成甲醇,反应方程式为:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol.