题目内容
19.己知1mol SO2(g)氧化为1mol SO3(g)的能量变化如图所示:反应过程
(1)由图可知该反应为放热(填“吸热”或“放热”)反应.
(2)该反应通常用V2O5作催化剂,加入V2O5会使图中E1减小(填“增大”、“减小”或“不变”),加入V2O5 后该反应的△H不变 (填“增大”、“减小”或“不变”).
(3)已知,2H2S(g)+O2(g)═2S(s)+2H2O(g)△H=-442.4kJ/mol ①
S(s)+O2(g)═SO2(g)△H=-297.0kJ/mol ②
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)韵热化学方程式是2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)△H=-1036.4kJ/mol.
分析 (1)反应物的能量高于产物,反应是放热的;
(2)E1为活化能,活化能的大小与反应热无关,加入催化剂能降低反应的活化能;
(3)已知2H2S(g)+O2(g)═2S(s)+2H2O(g)△H=-442.4kJ/mol ①
S(s)+O2(g)═SO2(g)△H=-297.0kJ/mol ②
①+②×2得到2H2S(g)+3O2(g)═2SO2(g)+2H2O(g),根据盖斯定律计算焓变.
解答 解:(1)根据图示:反应物的能量高于产物,所以反应是放热的;
故答案为:放热;
(2)E1为活化能,活化能的大小与反应热无关,加入催化剂能降低反应的活化能,故答案为:减小;不变;
(3)已知2H2S(g)+O2(g)═2S(s)+2H2O(g)△H=-442.4kJ/mol ①
S(s)+O2(g)═SO2(g)△H=-297.0kJ/mol ②
①+②×2得到2H2S(g)+3O2(g)═2SO2(g)+2H2O(g),根据盖斯定律,2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)△H=(-442.4kJ/mol)+2(-297.0kJ/mol)=-1036.4 kJ/mol.故答案为:2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)△H=-1036.4 kJ/mol.
点评 本题考查反应过程的能量变化图以及反应热的计算、盖斯定律的应用以及热化学方程式的书写知识,难度不大,注意活化能与反应热的关系是重点.

练习册系列答案
相关题目
9. 最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.图为该电池放电过程示意图,Cn为石墨烯,下列说法正确的是( )
最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.图为该电池放电过程示意图,Cn为石墨烯,下列说法正确的是( )
 最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.图为该电池放电过程示意图,Cn为石墨烯,下列说法正确的是( )
最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.图为该电池放电过程示意图,Cn为石墨烯,下列说法正确的是( )| A. | 充电时,每生成1mol Al,电解质溶液中会增加7molAlCl4- | |
| B. | 充电时,Cn为阳极,电极方程式为Cn+AlCl4--e-═Cn[AlCl4] | |
| C. | 放电时,正极反应方程式为Al+7AlCl4--3e-═4Al2Cl7- | |
| D. | 放电时,电解质中的阳离子(EMl+)会发生反应 |
10.下列物质中与0.3 molH2O含有相同氢原子数的是( )
| A. | 0.3molHNO3 | B. | 0.1mol H3PO4 | ||
| C. | 0.2molCH4 | D. | 3.612×1023个HCl分子 |
7.下列对一些实验事实的解释正确的是( )
| 选项 | 实验事实 | 解释 |
| A | 水加热到较高温度都难以分解 | 水分子间存在氢键 |
| B | 白磷为正四面体分子 | 白磷分子中P-P键间的键角是109°28′ |
| C | 用苯萃取碘水中的I2 | 苯和I2均为非极性分子且苯与水不互溶 |
| D | H2O的沸点高于H2S | H-O键的键长比H-S键的键长短 |
| A. | A | B. | B | C. | C | D. | D |
14.下列有关Al(NO3)3溶液的叙述正确的是( )
| A. | 该溶液中H+、Fe2+、SO42-、Cl-可以大量共存 | |
| B. | 向该溶液中通入SO2气体不会发生反应 | |
| C. | 向该溶液中加入过量氨水发生反应的离子方程式Al3++4NH3•H2O═AlO2-+4NH4++2H2O: | |
| D. | 向该溶液中滴入Na2CO3溶液发生反应的离子方程式:2Al3++3CO32-+3 H2O═2Al(OH)3↓+3CO2↑ |
4.下列离子方程式书写正确的是( )
| A. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 碳酸钙溶于稀醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 向碳酸氢铵稀溶液中加入过量烧碱溶液:NH4++OH-═NH3•H2O | |
| D. | 氢氧化钠溶液中通入过量二氧化碳:OH-+CO2═HCO3- |
11.下列化学用语表示正确的是( )
| A. | HClO的电子式: | |
| B. | 质子数为94、中子数为145的钚(Pu)原子:${\;}_{94}^{145}$Pu | |
| C. | 氯离子的结构示意图: | |
| D. | 对二甲苯的结构简式: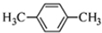 |
8.中华民族很早就把化学技术应用到生产、生活中.下列有关说法错误的是( )
| A. | 英文的“中国”(China)又指“瓷器”,中国很早就应用化学技术制作陶瓷 | |
| B. | “四大发明”之一黑火药是由硫黄、硝石、木炭三种物质按一定比例配制的混合物 | |
| C. | 《淮南万毕术》中有“曾青得铁则化为铜”的记载,其含义是铁可从铜盐溶液中置换出铜 | |
| D. | 杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来 |
