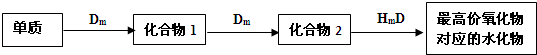
题目内容
(1)铜、锌和稀硫酸组成的原电池中,正极是 ,发生 ,电极反应是 ;负极是 ,发生 ,电极反应是 电池总的反应式(离子方程式)是
(2)在反应A(g)+3B(g)?2C(g)中,若以物质A表示化学反应速率为0.2mol/(L?min),则以物质B表示此反应的化学反应速率为 mol/(L?min)
(2)在反应A(g)+3B(g)?2C(g)中,若以物质A表示化学反应速率为0.2mol/(L?min),则以物质B表示此反应的化学反应速率为
考点:原电池和电解池的工作原理,反应速率的定量表示方法
专题:化学反应速率专题,电化学专题
分析:(1)铜、锌和稀硫酸组成的原电池中,活泼性强的Zn作负极,负极Zn失电子,Cu作正极,正极上氢离子得电子;
(2)根据化学反应速率之比等于化学计量数之比进行计算.
(2)根据化学反应速率之比等于化学计量数之比进行计算.
解答:
解:(1)铜、锌和稀硫酸组成的原电池中,活泼性强的Zn作负极,负极Zn失电子发生氧化反应,其电极方程式为:Zn-2e-=Zn2+,Cu作正极,正极上氢离子得电子,发生还原反应,其电极反应式为:2H++2e-=H2↑,电池的总的反应式(离子方程式)是Zn+2H+=H2↑+Zn2+;
故答案为:Cu;还原反应;2H++2e-=H2↑;Zn;氧化反应;Zn-2e-=Zn2+;Zn+2H+=H2↑+Zn2+;
(2)因化学反应速率之比等于化学计量数之比,即V(A):V(B)=1:3,而V(A)=0.2mol/(L?min),所以V(B)=0.6mol/(L?min),
故答案为:0.6.
故答案为:Cu;还原反应;2H++2e-=H2↑;Zn;氧化反应;Zn-2e-=Zn2+;Zn+2H+=H2↑+Zn2+;
(2)因化学反应速率之比等于化学计量数之比,即V(A):V(B)=1:3,而V(A)=0.2mol/(L?min),所以V(B)=0.6mol/(L?min),
故答案为:0.6.
点评:本题考查原电池的工作原理、反应速率的求算,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
现有73gHCl气体,则:
(1)该气体的物质的量为 mol.
(2)该气体所含原子总数为 个.
(3)该气体在标准状况下的体积为 L.
(4)该气体溶于水后形成1L溶液,其溶液的物质的量浓度为 mol/L.
(1)该气体的物质的量为
(2)该气体所含原子总数为
(3)该气体在标准状况下的体积为
(4)该气体溶于水后形成1L溶液,其溶液的物质的量浓度为
下列物质中,摩尔质量最大的是( )
| A、1g CaCO3 |
| B、0.8mol H2SO4 |
| C、54g Al |
| D、10ml H2O |