题目内容
下列判断中,正确的是( )
| A、工业上常通过电解熔融的MgO冶炼金属镁 |
| B、将NaOH溶液逐滴加入FeCl3溶液可制备Fe(OH)3胶体 |
| C、牡丹籽油是一种优良的植物油脂,它可使酸性高锰酸钾溶液褪色 |
| D、溴水不能区别四种有机溶剂:苯、四氯化碳、己烯、无水乙醇 |
考点:金属冶炼的一般原理,胶体的重要性质,有机物的鉴别,油脂的性质、组成与结构
专题:元素及其化合物,有机化学基础
分析:A.MgO的熔点为2852℃、熔点高,电解时耗能高,所以,工业上电解熔融MgCl2冶炼金属镁;
B.将NaOH溶液逐滴加入FeCl3溶液发生复分解反应,可制得Fe(OH)3沉淀;
C.含有碳碳不饱和键具有强还原性的物质能被高锰酸钾氧化;
D.苯、四氯化碳不溶于水,且二者密度不同,乙醇易溶于水,己烯与溴水发生加成反应;
B.将NaOH溶液逐滴加入FeCl3溶液发生复分解反应,可制得Fe(OH)3沉淀;
C.含有碳碳不饱和键具有强还原性的物质能被高锰酸钾氧化;
D.苯、四氯化碳不溶于水,且二者密度不同,乙醇易溶于水,己烯与溴水发生加成反应;
解答:
解:A.MgO、MgCl2均为离子化合物,因为MgO的熔点高于MgCl2,因此电解熔融MgCl2更经济,工业上常通过电解熔融的MgCl2冶炼金属镁,故A错误;
B.将NaOH溶液逐滴加入FeCl3溶液,发生:FeCl3+3NaOH=Fe(OH)3↓+3NaCl,实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,反应的化学方程式为FeCl3+3H2O
Fe(OH)3(胶体)+3HCl,故B错误;
C.牡丹籽油是一种优良的植物油脂,其分子中含有不饱和键,所以易被酸性高锰酸钾氧化,故C正确;
D.苯、四氯化碳不溶于水,且二者密度不同,苯密度比水小、四氯化碳密度比水大,乙醇易溶于水,己烯与溴水发生加成反应,可鉴别,故D错误;
故选C.
B.将NaOH溶液逐滴加入FeCl3溶液,发生:FeCl3+3NaOH=Fe(OH)3↓+3NaCl,实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,反应的化学方程式为FeCl3+3H2O
| ||
C.牡丹籽油是一种优良的植物油脂,其分子中含有不饱和键,所以易被酸性高锰酸钾氧化,故C正确;
D.苯、四氯化碳不溶于水,且二者密度不同,苯密度比水小、四氯化碳密度比水大,乙醇易溶于水,己烯与溴水发生加成反应,可鉴别,故D错误;
故选C.
点评:本题考查胶体的制备、性质、物质的鉴别,题目难度不大,易错点为胶体的制备,注意D把握物质的性质及反应中的不同现象为鉴别的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
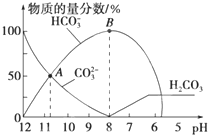 常温下,在10mL 0.1mol?L-1 Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL 0.1mol?L-1 Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )| A、在0.1 mol?L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B、当溶液的pH为7时,溶液的总体积为20 mL |
| C、在B点所示的溶液中,浓度最大的阳离子是Na+ |
| D、在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) |
两支试管中分别加入足量的等物质的量浓度的稀硫酸和氢氧化钠溶液,然后分别加入等质量的金属铝,充分反应,放出气体的体积比为( )
| A、2:3 | B、3:2 |
| C、1:3 | D、1:1 |
在一固定容积的密闭容器中,可逆反应N2+3H2?2NH3达到平衡的标志是( )
| A、v(N2)正=v(NH3)逆 |
| B、单位时间内3molH-H键断裂,同时6mol N-H键断裂 |
| C、n(N2):n(H2):(NH3)=1:3:2 |
| D、反应混合物各组分的物质的量浓度还在改变 |
化学创造了生活,也在改变着我们的生活.下列与化学有关的说法正确的是( )
| A、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,在空气中能产生丁达尔现象 |
| B、在海轮外壳上镶嵌锌块,会减缓船体的锈蚀 |
| C、经过必要的化学变化能从海水中提取NaCl、Mg、Br2等物质 |
| D、大量燃烧化石燃料排放的废气中大量CO2、SO2,造成大气污染,从而使雨水的PH=5.6形成酸雨 |
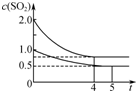 向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g);△H=-197.74kJ?mol-1.
向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g);△H=-197.74kJ?mol-1.一段时间后达到平衡,测得两容器中c(SO2)(mol?L-1)随时间t(min)的变化关系如图所示.下列说法正确的是( )
| A、热量:Q(甲)<2Q(乙) |
| B、压强:p(甲)<2p(乙) |
| C、乙中前5 min内的反应速率v(O2)=0.10 mol?L-1?min-1 |
| D、保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,则此时v(正)<v(逆) |
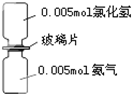 如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )
如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )| A、气体反应物的总体积为0.224L |
| B、产物中所含的N-H键个数为0.02NA |
| C、生成物中含有0.005NA个分子 |
| D、加1L水溶解后所得溶液中阳离子浓度为0.005mol?L-1 |
下列有关物质性质的应用正确的是( )
| A、石英坩埚耐高温,可用来加热熔化NaOH固体 |
| B、浓硫酸有脱水性,可用作干燥剂 |
| C、二氧化硫有漂白性,可大量用于加工食品使食品漂白 |
| D、医用酒精能使蛋白质变性,可用来消毒杀菌 |
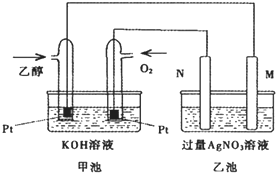 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: