题目内容
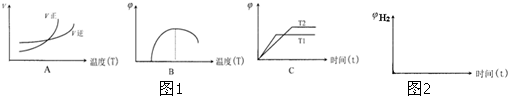
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”.工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如图1:
已知:2H2SO4(浓)+FeTiO3═TiOSO4+FeSO4+2H2O
(1)步骤I中发生反应的离子方程式: 、 .
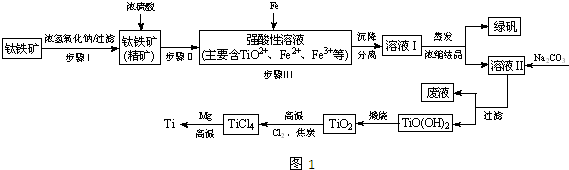
(2)已知:TiO2+易水解,只能存在于强酸性溶液中.25℃时,难溶电解质溶解度与pH关系如图2,TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因是 .
②TiO2+水解的离子方程式为 .向溶液Ⅱ中加入Na2CO3粉末的作用是 .当溶液pH= 时,TiO(OH)2已沉淀完全.
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据如表信息,需加热的温度略高于 ℃即可.
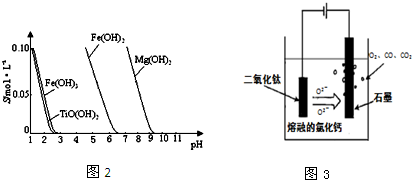
(4)电解TiO2制备钛的方法如图3所示.该方法由于具备生产过程简化、生产成本低、产品质量高、环境友好等诸多优点而引人注目.已知TiO2熔融状态下不发生电离,电解时阴极反应式为 .

已知:2H2SO4(浓)+FeTiO3═TiOSO4+FeSO4+2H2O
(1)步骤I中发生反应的离子方程式:
(2)已知:TiO2+易水解,只能存在于强酸性溶液中.25℃时,难溶电解质溶解度与pH关系如图2,TiO(OH)2溶度积Ksp=1×10-29

①步骤Ⅲ加入铁屑原因是
②TiO2+水解的离子方程式为
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据如表信息,需加热的温度略高于
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
考点:制备实验方案的设计
专题:实验设计题
分析:(1)根据钛铁矿的成分可知与氢氧化钠溶液反应的物质是氧化铝和二氧化硅,离子方程式为Al2O3+2OH-═2AlO2-+H2O;SiO2+2OH-═SiO32-+H2O;
(2)①根据实验目的结合TiO(OH)2与Fe(OH)3沉淀的pH分析;
②TiO2+易水解,只能存在于强酸性溶液中,所以TiO2+水解生成TiO(OH)2与H+,离子方程式为TiO2++2H2O?TiO(OH)2+2H+; 从流程图中可看出加入碳酸钠溶液后得到TiO(OH)2沉淀分析加入Na2CO3粉末的作用;根据图判断pH证明TiO(OH)2已沉淀完全;
(3)根据Mg、MgCl2、Ti的熔沸点分析;
(4)根据电解时阴极发生还原反应,结合TiO2熔融状态下不发生电离书写;
(2)①根据实验目的结合TiO(OH)2与Fe(OH)3沉淀的pH分析;
②TiO2+易水解,只能存在于强酸性溶液中,所以TiO2+水解生成TiO(OH)2与H+,离子方程式为TiO2++2H2O?TiO(OH)2+2H+; 从流程图中可看出加入碳酸钠溶液后得到TiO(OH)2沉淀分析加入Na2CO3粉末的作用;根据图判断pH证明TiO(OH)2已沉淀完全;
(3)根据Mg、MgCl2、Ti的熔沸点分析;
(4)根据电解时阴极发生还原反应,结合TiO2熔融状态下不发生电离书写;
解答:
解:(1)根据钛铁矿的成分可知与氢氧化钠溶液反应的物质是氧化铝和二氧化硅,离子方程式为Al2O3+2OH-═2AlO2-+H2O;SiO2+2OH-═SiO32-+H2O;故答案为:Al2O3+2OH-═2AlO2-+H2O;SiO2+2OH-═SiO32-+H2O;
(2)①由图可知TiO(OH)2与Fe(OH)3沉淀的pH很接近,所以加入铁粉目的是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀,故答案为:将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀;
②TiO2+易水解,只能存在于强酸性溶液中,所以TiO2+水解生成TiO(OH)2与H+,离子方程式为TiO2++2H2O?TiO(OH)2+2H+;从流程图中可看出加入碳酸钠溶液后得到TiO(OH)2沉淀,所以向溶液II中加入Na2CO3粉末的作用是调节溶液pH值,使TiO2+水解平衡正向移动;由图可知,pH=2时TiO(OH)2已沉淀完全,
故答案为:TiO2++2H2O?TiO(OH)2+2H+;调节溶液pH值,促进TiO2+水解; 2;
(3)Mg、MgCl2的沸点最高是1412℃,而Ti的熔点为1667℃,所以当温度略高于1412℃时Mg、MgCl2以气体的形式除去,得到Ti,故答案为:1412;
(4)电解时阴极发生还原反应,因为TiO2熔融状态下不发生电离,所以是TiO2得电子生成Ti单质和O2-,电极反应式为TiO2+4e-=Ti+2O2-,
故答案为:TiO2+4e-=Ti+2O2-;
(2)①由图可知TiO(OH)2与Fe(OH)3沉淀的pH很接近,所以加入铁粉目的是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀,故答案为:将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀;
②TiO2+易水解,只能存在于强酸性溶液中,所以TiO2+水解生成TiO(OH)2与H+,离子方程式为TiO2++2H2O?TiO(OH)2+2H+;从流程图中可看出加入碳酸钠溶液后得到TiO(OH)2沉淀,所以向溶液II中加入Na2CO3粉末的作用是调节溶液pH值,使TiO2+水解平衡正向移动;由图可知,pH=2时TiO(OH)2已沉淀完全,
故答案为:TiO2++2H2O?TiO(OH)2+2H+;调节溶液pH值,促进TiO2+水解; 2;
(3)Mg、MgCl2的沸点最高是1412℃,而Ti的熔点为1667℃,所以当温度略高于1412℃时Mg、MgCl2以气体的形式除去,得到Ti,故答案为:1412;
(4)电解时阴极发生还原反应,因为TiO2熔融状态下不发生电离,所以是TiO2得电子生成Ti单质和O2-,电极反应式为TiO2+4e-=Ti+2O2-,
故答案为:TiO2+4e-=Ti+2O2-;
点评:本题综合考查了元素化合物的性质知识,注意物质分离的流程分析判断,物质性质的应用,离子性质的应用,分离操作的方法,电解池原理的应用,电极反应的书写原则等,要求学生具有分析和解决问题的能力,有利于培养学生的良好的科学素养,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、化合反应一定是放热反应 |
| B、乙二醇和丙三醇都易溶于水和乙醇 |
| C、牺牲阳极的阴极保护法是利用了电解原理 |
| D、相同条件下,CuSO4溶液比FeCl3溶液使H2O2分解速率更快 |

 某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图.依图回答:
某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图.依图回答:
 今有某一种碱金属的两种碳酸盐和碱土金属(第ⅡA族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标况下),另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g.
今有某一种碱金属的两种碳酸盐和碱土金属(第ⅡA族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标况下),另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g. 用如图所示的收集装置收集氨气时,由于气流略强使得在试管底部形成气旋,导致氨气与空气混合而不能收集到纯氨气.现在有一小团棉花,请问将棉花放在试管那个位置可以阻止气旋?请说明理由.
用如图所示的收集装置收集氨气时,由于气流略强使得在试管底部形成气旋,导致氨气与空气混合而不能收集到纯氨气.现在有一小团棉花,请问将棉花放在试管那个位置可以阻止气旋?请说明理由.