题目内容
【题目】铬渣(铬主要以Cr2O3形式存在,同时含有Al2O3、SiO2等杂质)是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬产生的环境污染。铬渣综合利用工艺流程如下:

请回答下列问题:
(1)焙烧得到的产物含有Na2CrO4和一种无污染的气体,则生成Na2CrO4的反应方程式为_____ 。
(2)除去浸出液中的杂质最好加入_____(填试剂名称)来调节pH。除去铝元素的离子方程式为______________。
(3)理论上加入醋酸铅、硝酸铅均可以得到铬酸铅沉淀,工艺流程中不选用醋酸铅的原因是___________。
(4)铬酸铅是一种用于水彩和油彩的筑色颜料.遇到空气中的硫化物颜色会变然,该过积的化学反应方程式为_____________。
(5)实验室常利用Cr3+在碱性溶液中的还原性,使其转化为CrO42-,从而实现与Al3+的分离,这个过程中需要加入的试剂是__________(填化学式),分离操作是_________。
【答案】 5 Cr2O3+14 NaOH+6 NaNO3 ==10 Na2CrO4+3 N2↑+7 H2O 硝酸 ![]() +
+![]() +H2O==Al(OH)3↓ 不引入新的杂质②得到的NaNO3可以循环利用 PbCrO4+H2S==PbS+H2CrO4 NH3·H2O、H2O2 过滤
+H2O==Al(OH)3↓ 不引入新的杂质②得到的NaNO3可以循环利用 PbCrO4+H2S==PbS+H2CrO4 NH3·H2O、H2O2 过滤
【解析】本题分析:本题主要考查离子反应。
(1)焙烧得到的产物含有Na2CrO4和一种无污染的气体氮气,则生成Na2CrO4的反应的化学方程式为5Cr2O3+14NaOH+6NaNO3 =10Na2CrO4+3N2↑+7H2O。
(2)为了不引人新的杂质,除去浸出液中的杂质最好加入硝酸来调节pH。除去铝元素的离子方程式为![]() +
+![]() +H2O=Al(OH)3↓。
+H2O=Al(OH)3↓。
(3)工艺流程中不选用醋酸铅的原因是不引入新的杂质。
(4)铬酸铅遇到空气中的硫化物颜色会变黑,该过程的化学方程式为PbCrO4+H2S=PbS+H2CrO4。
(5)加入NH3·H2O 提供碱性环境,而且将Al3+转化为氢氧化铝沉淀,NH3·H2O不会溶解氢氧化铝沉淀,加入H2O2将Cr3+氧化为CrO42-,不会引人杂质,所以这个过程中需要加入的试剂是NH3·H2O、H2O2,分离操作是过滤。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】实验室制备硝基苯的反应原理和实验装置如下:

存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯,有关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 密度/ g·cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
实验步骤如下:
取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60 ℃下发生反应,直至反应结束。

将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝酸基苯18 g。回答下列问题:
(1)装置B的名称是___________,装置C的作用是____________________。
(2)配制混合液时,________(填“能”或“不能”)将浓硝酸加入到浓硫酸中,说明理由:____________________________________________。
(3)为了使反应在50~60 ℃下进行,常用的方法是____________。
(4)在洗涤操作中,第二次水洗的作用是_____________________。
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140 ℃,应选用空气冷凝管,不选用直形冷凝管的原因是________________________________。
(6)本实验所得到的硝基苯产率是______________________________。
【题目】实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
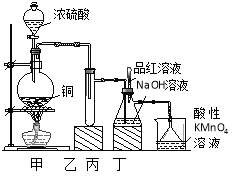
(1)装置乙的作用是_____________________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为 。
(3) SO2 气体有漂白性、还原性和氧化性。将SO2 通入氯水中,SO2表现的是________性,化学反应方程式为 。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为 ,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。
请设计实验探究吸收后产物中是否存在NaHSO3 和 Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
实验操作 | 预期现象与结论 |
步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 | |
步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再 | 若品红褪色(或有气泡),则 |
步骤3: | 若 则 ; 否则 。 |
