题目内容
【题目】实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
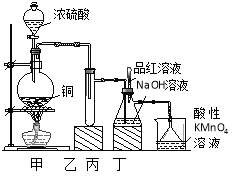
(1)装置乙的作用是_____________________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为 。
(3) SO2 气体有漂白性、还原性和氧化性。将SO2 通入氯水中,SO2表现的是________性,化学反应方程式为 。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为 ,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。
请设计实验探究吸收后产物中是否存在NaHSO3 和 Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
实验操作 | 预期现象与结论 |
步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 | |
步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再 | 若品红褪色(或有气泡),则 |
步骤3: | 若 则 ; 否则 。 |
【答案】(17分)
(1)(2分)防止丙中液体倒吸入装置甲中(或缓冲瓶的作用)
(2)(3分) 5SO2+2MnO4-+2H2O =5SO42-+2Mn2++4H+
(3)3分)还原性(1分) SO2+Cl2+2H2O=H2SO4+2HCl(2分)
(4)(2分)品红溶液褪色
(5)(7分)
实验操作 | 预期现象与结论 |
步骤2:再滴入过量2mol/L盐酸(1分),振荡(1分) | 产物中存在Na2SO3(1分) |
步骤3:用试管取适量滤液A(1分),向其中 加入过量lmol/L氢氧化钡溶液(或滴入2滴品红,再滴入过量2mol/L盐酸。),振荡(1分) | 若出现浑浊(或红色褪去),则产物中存在NaHSO3(1分);否则不存在NaHSO3(1分)。 |
评分说明:
(1)文字中只要写出加有着重号的文字、化学式或类似的意思,该评分点给分;
(2)用品红检验SO32-或HSO3-时:①如果先加盐酸、后加品红,SO2量少且挥发一部分,可能会出现品红不褪色而误判,这种情况两处合起来扣1分;②如果不加品红、只滴盐酸,两处合起来扣1分。
【解析】
试题分析:(1)读图可知,装置甲中Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,SO2不仅易溶于水,而且易溶于装置丙中的NaOH溶液,因此丙中溶液易倒吸进入甲装置内的浓硫酸中,易造成安全事故,所以装置乙的作用就是防止丙中液体倒吸入装置甲中(或起缓冲瓶或安全瓶的作用);(2)丁装置中KMnO4作强氧化剂,SO2作还原剂,锰元素由+7价降为+2价,硫元素由+4价升为+6价,根据化合价升降总数相等、原子个数守恒可知,2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4,或者5SO2+2MnO4-+2H2O =5SO42-+2Mn2++4H+;(3)氯水是强氧化剂,可以将SO2氧化为SO42-,即SO2+Cl2+2H2O=H2SO4+2HCl,则SO2是还原剂,显还原性;(4)若SO2不足,丙中反应为SO2+2NaOH=Na2SO3+H2O;若SO2过量,丙中先发生的反应为SO2+2NaOH=Na2SO3+H2O,后发生的反应为Na2SO3+H2O+SO2=2NaHSO3,由此推断丙中SO2过量,则滴入品红溶液会褪色,因为二氧化硫具有漂白性;(5)Na2SO3与BaCl2易反应生成BaSO3沉淀,而NaHSO3与BaCl2不能反应;BaSO3易溶于盐酸,并放出能使品红溶液褪色的SO2气体,因此步骤2中先向洗涤后的固体滴入2滴或少量品红溶液,再滴入过量2mol/L盐酸,振荡,若固体完全溶解,品红褪色或有气泡,则装置丙的产物中含有Na2SO3;由于可溶性的NaHSO3易与Ba(OH)2反应生成BaSO3沉淀,或者NaHSO3易与盐酸反应放出能使品红溶液褪色的SO2气体,故步骤3中可用试管取适量滤液A,向其中加入过量lmol/L氢氧化钡溶液(或滴入2滴品红,再滴入过量2mol/L盐酸),振荡,若出现浑浊(或红色褪去),则装置丙的产物中存在NaHSO3;否则不存在NaHSO3。
CuSO4+SO2↑+2H2O,SO2不仅易溶于水,而且易溶于装置丙中的NaOH溶液,因此丙中溶液易倒吸进入甲装置内的浓硫酸中,易造成安全事故,所以装置乙的作用就是防止丙中液体倒吸入装置甲中(或起缓冲瓶或安全瓶的作用);(2)丁装置中KMnO4作强氧化剂,SO2作还原剂,锰元素由+7价降为+2价,硫元素由+4价升为+6价,根据化合价升降总数相等、原子个数守恒可知,2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4,或者5SO2+2MnO4-+2H2O =5SO42-+2Mn2++4H+;(3)氯水是强氧化剂,可以将SO2氧化为SO42-,即SO2+Cl2+2H2O=H2SO4+2HCl,则SO2是还原剂,显还原性;(4)若SO2不足,丙中反应为SO2+2NaOH=Na2SO3+H2O;若SO2过量,丙中先发生的反应为SO2+2NaOH=Na2SO3+H2O,后发生的反应为Na2SO3+H2O+SO2=2NaHSO3,由此推断丙中SO2过量,则滴入品红溶液会褪色,因为二氧化硫具有漂白性;(5)Na2SO3与BaCl2易反应生成BaSO3沉淀,而NaHSO3与BaCl2不能反应;BaSO3易溶于盐酸,并放出能使品红溶液褪色的SO2气体,因此步骤2中先向洗涤后的固体滴入2滴或少量品红溶液,再滴入过量2mol/L盐酸,振荡,若固体完全溶解,品红褪色或有气泡,则装置丙的产物中含有Na2SO3;由于可溶性的NaHSO3易与Ba(OH)2反应生成BaSO3沉淀,或者NaHSO3易与盐酸反应放出能使品红溶液褪色的SO2气体,故步骤3中可用试管取适量滤液A,向其中加入过量lmol/L氢氧化钡溶液(或滴入2滴品红,再滴入过量2mol/L盐酸),振荡,若出现浑浊(或红色褪去),则装置丙的产物中存在NaHSO3;否则不存在NaHSO3。

 阅读快车系列答案
阅读快车系列答案