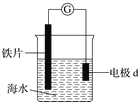
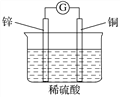
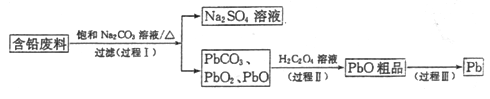
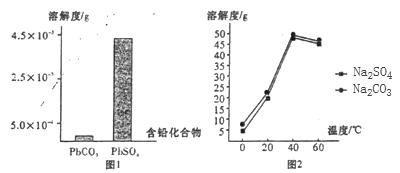
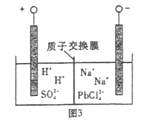
题目内容
【题目】下列溶液中溶质的物质的量浓度为1mol/L的是()
A. 含K+为2mol的K2SO4溶液
B. 将58.5NaCl溶解于1L水中
C. 将0.5mol·L-1的NaNO3溶液100mL加热蒸发掉50克水的溶液
D. 将80gSO3溶于水并配成1L溶液
【答案】D
【解析】A.没有注明溶液的体积,无法计算含K+为2mol的K2SO4溶液的物质的量浓度,故A错误;B.将58.5NaCl溶解于1L水中,在物质的量浓度的计算公式中体积指溶液体积不是溶剂体积,所以将58.5NaCl溶解于1L水中配成的NaCl溶液浓度不是1mol/L,故B错误;C.加热蒸发掉50g水后的溶液体积不是50mL,则溶液浓度不是1mol/L,故C错误;D.80gSO3的物质的量为![]() =1mol,溶于水配成1L溶液,溶液浓度为1mol/L,故D正确;故选D。
=1mol,溶于水配成1L溶液,溶液浓度为1mol/L,故D正确;故选D。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目