题目内容
2.按照要求回答下列问题(1)硫酸铁溶液显酸性的原因Fe3++3H2O?Fe(OH)3+3H+(用离子方程式表示).
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合溶液中c(CH3COO-)=c(Na+),则混合后溶液显中性.
(3)浓度均为0.1mol/L①氯化铵②醋酸铵③硫酸氢铵④氨水四种溶液中,c(NH4+)由大到小的顺序④②①③(填序号).
(4)将化合物A的蒸气1mol充入0.5L容器中加热分解:2A(g)?B(g)+nC(g),反应到3min时,容器内A的浓度为0.8mol/L,测得这段时间内,平均速率ν(C)=0.6mol/(L•min),则化学方程式中的n值为3,ν(B)=0.2mol•L-1•min-1,此时A的分解率为60%.
分析 (1)硫酸铁溶液中,铁离子部分水解,溶液显示酸性;
(2)根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),分析判断;
(3)从盐类的水解和弱电解质的电离程度角度分析,醋酸铵中醋酸根离子水解促进铵根离子,硫酸氢铵溶液中氢离子抑制铵根离子水解,一水合氨为弱电解质电离程度小;
(4)根据v=$\frac{△c}{△t}$计算v(A),利用速率之比等于化学计量数之比计算v(B)及n的值,分解率=$\frac{分解量}{起始量}$×100%;
解答 解:(1)硫酸铁溶液中,铁离子结合水电离的氢氧根离子生成氢氧化铁,溶液中氢离子浓度大于氢氧根离子,溶液显示酸性,铁离子水解的方程式为:Fe3++3H2O?Fe(OH)3+3H+,
故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(2)根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),溶液中醋酸根离子和钠离子浓度相等,则c(H+)=c(OH-),溶液为中性,
故答案为:中;
(3)浓度均为0.1mol/L①氯化铵②醋酸铵③硫酸氢铵④氨水四种溶液中存在:NH4++H2O?NH3•H2O+H+,硫酸氢铵存在大量的H+,抑制NH4+的水解,醋酸铵为弱酸弱碱盐,发生相互促进的水解,盐中NH4+浓度最小,氨水为弱电解质,难以电离,在这五种溶液中NH4+浓度最小,所以NH4+浓度由小到大的顺序是:④②①③,故答案为:④②①③;
(4)反应到3min时,容器内A的浓度为0.8mol•L-1,则v(A)=$\frac{\frac{1mol}{0.5L}-0.8mol/L}{3min}$=0.4mol•L-1•min-1,这段时间内,平均速率ν(C)=0.6mol•L-1•min-1,
速率之比等于化学计量数之比,故0.4:0.6=2:n,解得n=3,v(B)=$\frac{1}{2}$v(A)=0.2mol•L-1•min-1,此时A的分解率=$\frac{1mol-0,8mol/L×0.5L}{1mol}$×100%=60%,
故答案为:3;0.2mol•L-1•min-1;60%;
点评 本题考查化学反应速率有关计算、离子浓度大小比较、盐类水解、化学平衡影响因素等,题目难度不大,注意对反应速率规律的理解应用

| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| C. | 氯水中放入有色布条,有色布条褪色,说明溶液中有Cl2存在 | |
| D. | 1.12LCl2含有1.7NA个质子(NA表示阿伏伽德罗常数) |
| A. | 量筒 | B. | 试管 | C. | 蒸发皿 | D. | 烧瓶 |
| A | B | C | D |
| 《本草经集注》记载“以火烧之,紫青烟起,云是真硝石(硝酸钾)也” | 碳酸氢钠药片 |  |  |
| 钾的焰色反应颜色为紫色 | 该药是抗酸药,服用时喝些醋能提高药效 | 看到有该标志的丢弃物,应远离并报警 | 该物品可做消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
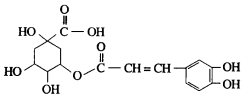 金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )
金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )| A. | 绿原酸的分子式为C16H8O9 | |
| B. | 1个绿原酸分子中含有4个手性碳原子 | |
| C. | 1mol绿原酸最多与4molNaOH反应 | |
| D. | 1mol绿原酸最多能与4molH2发生反应 |
| A. | 含有大量Ba(NO3 )2的溶液中:Mg2+、NH4+、SO42-、Cl- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 在碱性溶液中:Na+、K+、SO42-、CO32- | |
| D. | 在酸性的溶液中:Na+、K+、CO32-、NO3- |
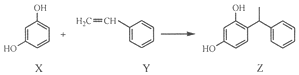
下列叙述错误的是( )
| A. | X和Z均能与FeCl3溶液反应显紫色 | |
| B. | X和Z均能与NaHCO3溶液反应放出CO2 | |
| C. | Y既能发生取代反应,也能发生加成反应 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |