题目内容
18. (1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.
(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.A.若υ正(O2)=2υ逆(SO3),说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2mol N2,化学反应速率加快
C.平衡后移动活塞压缩气体,达到新平衡时SO2、O2的百分含量减小,SO3的百分含量增大
D.达平衡后,保持温度和容器体积不变,再充入2mol SO2,化学平衡向右移动,SO2的转化率增大.
(2)尾气SO2用NaOH溶液吸收后会生成Na2SO3.,实验测定常温下0.1mol/L Na2SO3溶液的pH为8,该溶液中由水电离出的氢氧根离子的浓度为10-6.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数的对数值与温度的关系如下.
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1=lgK2-lgK3(用lgK2和lgK3来表示).
分析 (1)恒温恒压容器达到平衡,反应是气体体积减小的放热反应,依据平衡移动原理分析选项,平衡标志是正逆反应速率相同,各组分含量保持不变;
(2)根据pH求出c(OH-),氢氧根来源于水的电离;
(3)①由图可知,温度越高,K值越大,说明此反应为吸热反应;
②由图可知:温度升高,反应向正反应方向移动,硫的脱除率越高;
③由图可知:1000K时,平衡常数的对数lgK1=2、lgK2=-1、lgK3=-3,据此解答即可.
解答 解:(1)恒温恒压容器达到平衡,反应是气体体积减小的放热反应;
A.反应速率之比等于化学方程式系数之比,是正反应速率之比,若反应速率2υ正(O2)=υ逆(SO3),才可以说明该可逆反应已达到平衡状态,故A错误;
B.保持温度和容器体积不变,充入2mol N2,总压增大,气体分压不变,即各种反应物和生成物的浓度不变,化学反应速率不变,故B错误;
C.平衡后移动活塞压缩气体,压强增大,平衡正向进行,平衡时SO2、O2的百分含量减小,SO3的百分含量增大,故C正确;
D.加入反应物二氧化硫,可以提高氧气的转化率,但是二氧化硫本身的转化率减小,故D错误,
故选C;
(2)pH=8,c(OH-)=10-14÷10-8=10-6mol•L-1,故答案为:10-6;
(3)①由图可知,温度越高,K值越大,说明此反应为吸热反应,故△H>0,故答案为:>;温度升高,平衡常数增大;
②由图可知:此反应为吸热反应,故升高温度,可以使反应向正向移动,即硫的脱除率越高,故答案为:升高温度;
③由图可知:1000K时,平衡常数的对数lgK1=2、lgK2=-1、lgK3=-3,故lgK2=lgK1+lgK3,故答案为:lgK1=lgK2-lgK3.
点评 本题主要考查的是化学平衡移动的判断、离子浓度有关计算等,难度一般.

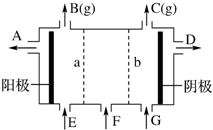 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )| A. | b是阳离子交换膜,允许Na+通过 | B. | 从A口出来的是NaOH溶液 | ||
| C. | 阴极反应式为4OH--4e-═2H2O+O2↑ | D. | Na2SO4溶液从G口加入 |
 一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池的电解质为6mol/LKOH溶液,下列说法正确的是( )
一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池的电解质为6mol/LKOH溶液,下列说法正确的是( )| A. | 放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| B. | 放电时OH-移向镍电极 | |
| C. | 充电时碳电极反应为H2-2e-+2OH-=2H2O | |
| D. | 充电时将碳电极与电源的正极相连 |
| A. | 在(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 将pH=1的醋酸和pH=13的NaOH溶液等体积混合后的溶液c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 等体积等物质的量浓度的NaCl和CH3COONa两种溶液中离子总数:前者小于后者 | |
| D. | 等体积等物质的量浓度的HCl溶液和CH3COONa溶液混合后:c(CH3COOH)+c(CH3COO-)═c(Na+) |
| A. | pH=2的盐酸溶液中含有的阳离子数为0.02NA | |
| B. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| C. | 标准状况下,22.4L CHCl3所含有的分子数目为NA | |
| D. | 27g铝与足量的盐酸或NaOH溶液反应转移的电子数目均为3NA |
| A. | a、c两元素处在元素周期表的VIA族 | |
| B. | b、d两种元素可组成化学式为d2b2的化合物,且阴阳离子个数比为1:2 | |
| C. | c单质可在b单质中燃烧生成的化合物的分子式为cb2 | |
| D. | c的单质可用来制作光导纤维 |
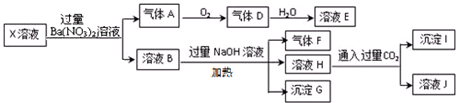
| A. | X中肯定存在Fe2+、A13+、NH4+、C1- | |
| B. | X中不能确定的离子是 K+和C1- | |
| C. | 沉淀G在空气中放置过程中,沉淀颜色会由白色变为灰绿色最后变为红褐色 | |
| D. | 标准状况下将一试管D气体倒扣在水槽中充分吸收(假设所得溶液没有扩散),所得溶液物质的量浓度约为0.036mol/L |
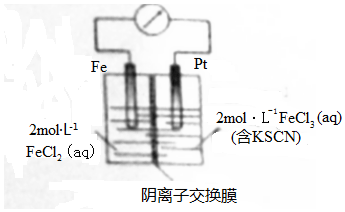
| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e-=Fe | |
| D. | 若转移2mole-,交换膜右侧溶液中约减少3mol离子 |