题目内容
20.卤族元素中非金属性最强的是F,原子半径最小的是F,氧化性最强的是F2.(填元素符号或化学式)分析 同主族元素从上到下金属性(氧化性)依次增强,非金属性依次减弱;原子半径从上到下依次增大,据此回答.
解答 解:卤族元素从上到下金属性(氧化性)依次增强,非金属性依次减弱,非金属性最强的是F,氧化性最强的是F2,原子半径从上到下依次增大,原子半径最小的是F.
故答案为:F;F;F2.
点评 本题以卤素为例考查了同主族元素原子间性质的递变规律,难度不大,注意基础知识的积累.

练习册系列答案
相关题目
10.下列关于原子核外电子排布规律的说法错误的是( )
| A. | K层是能量最低的电子层 | |
| B. | 原子失电子时先失去能量低的电子 | |
| C. | 核外电子总是优先排布在能量较低的电子层上 | |
| D. | N层为次外层时,最多可容纳的电子数为18 |
11.下列有关有机物的物理性质或用途描述正确的是( )
| A. | 七氟丙烷可以用来做灭火剂 | |
| B. | 正戊烷、异戊烷和新戊烷的沸点依次升高 | |
| C. | 苯酚与水形成的浊液静置后分层,下层是溶有苯酚的水层 | |
| D. | 常温下卤代烃均为气态 |
8.下列系统命名法正确的是( )
| A. | 2-甲基-4-乙基戊烷 | B. | 2-甲基-3-丁炔 | ||
| C. | 2,3-二乙基-1-戊烯 | D. | 三溴苯酚 |
5.在光照条件下,将等物质的量的甲烷和氯气充分反应,所得产物中物质的量最多的是( )
| A. | CH3Cl | B. | CH2Cl | C. | CHCl3 | D. | HCl |
10.核内中子数为N的R2+离子,质量数为A,则ng它的氧化物中所含质子的物质的是( )
| A. | $\frac{n}{16+A}$(A-N+8)mol | B. | $\frac{n}{16+A}$(A-N+10)mol | C. | (A-N+2)mol | D. | $\frac{n}{A}$(A-N+6)mol |
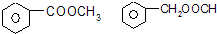 .
.


