题目内容
某同学设计的铜锌原电池如图所示,则下列说法正确的是( )


| A、因为锌与硫酸锌,铜与硫酸铜不反应,所以该装置无法工作 |
| B、电池反应为:Zn2++Cu═Zn+Cu2+ |
| C、盐桥中的Cl-移向ZnSO4溶液 |
| D、在外电路中,电流从负极流向正极 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.该装置符合原电池构成条件,所以能构成原电池;
B.负极上锌失电子生成锌离子,正极上铜离子得电子生成铜单质,在得失电子数相等的条件下,正负极电极反应式相加即得电池反应式;
C.盐桥中阴离子向负极移动,阳离子向正极移动;
D.外电路中,电流从正极沿导线流向负极.
B.负极上锌失电子生成锌离子,正极上铜离子得电子生成铜单质,在得失电子数相等的条件下,正负极电极反应式相加即得电池反应式;
C.盐桥中阴离子向负极移动,阳离子向正极移动;
D.外电路中,电流从正极沿导线流向负极.
解答:
解:A.该装置符合原电池构成条件,所以能构成原电池,锌易失电子而作负极,铜作正极,所以该装置能正常工作,故A错误;
B.该装置中负极电极反应式为Zn-2e-=Ze2+,正极上电极反应式为Cu 2++2e-=Cu,所以电池反应式为Zn+Cu2+═Zn2++Cu,故B错误;
C.盐桥中阴离子向负极移动,阳离子向正极移动,锌作负极,铜作正极,所以氯离子向硫酸锌溶液移动,故C正确;
D.外电路中,电流从正极铜沿导线流向负极锌,电子从负极锌沿导线流向正极铜,故D错误;
故选C.
B.该装置中负极电极反应式为Zn-2e-=Ze2+,正极上电极反应式为Cu 2++2e-=Cu,所以电池反应式为Zn+Cu2+═Zn2++Cu,故B错误;
C.盐桥中阴离子向负极移动,阳离子向正极移动,锌作负极,铜作正极,所以氯离子向硫酸锌溶液移动,故C正确;
D.外电路中,电流从正极铜沿导线流向负极锌,电子从负极锌沿导线流向正极铜,故D错误;
故选C.
点评:本题考查了原电池原理,明确正负极上得失电子、盐桥中阴阳离子移动方向、电子和电流的流向即可解答,难度不大.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+6H+=3I2+3H2O |
| B、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| C、石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
| D、钠与水的反应:Na+H2O=Na++OH-+H2↑ |
下列有关实验原理或操作不正确的是( )
A、 如图装置可测定反应速率 |
B、 用如图装置制备Fe(OH)2 |
C、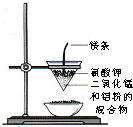 用如图装置制取少量金属锰 |
D、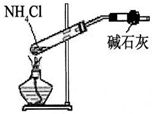 实验室用如图所示装置制取少量氨气 |
下列反应的离子方程式书写正确的是( )
| A、大理石和盐酸的反应:CO32-+2H+=CO2↑+H2O | ||||
| B、向氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ | ||||
| C、氯气与氢氧化钠溶液反应:Cl2+OH-=Cl-+HClO | ||||
D、电解饱和食盐水:2Cl-+2H2O
|
常温下,将v1mL c1mol?L-1的氨水逐滴滴加到v2mL c2mol?L-1的盐酸中,下列结论中正确的是( )
| A、若v1=v2c1=c2,则混合液中c(NH4+)=c(C1-) |
| B、若混合液的pH=7,则混合液中c(NH4+)>c(C1-) |
| C、若v1=v2且pH<7,则一定有c1<c2 |
| D、若混合液的pH=7,则c1v1>c2v2 |
下列说法正确的是( )
| A、电解稀硫酸溶液,溶液的浓度会逐渐变大,pH逐渐变大 |
| B、氯碱工业中,电路中每转移1mol电子,理论上收集到1mol气体 |
| C、向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度 |
| D、粗铜精炼时,粗铜应作电解池的阳极,电解质溶液在电解过程中浓度不变 |
以下烃中,一氯化物只有一种的是( )
| A、乙烷 | B、对二甲苯 |
| C、2-甲基丁烷 | D、丙烷 |