题目内容
2.X、Y、Z、W、R是五种短周期元素,其原子序数依次增加.X是元素周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,且Z在同周期中原子半径最大.下列说法正确的是( )| A. | 元素Y、Z、W具有相同电子层的离子,其半径依次增大 | |
| B. | 元素X能与元素Y形成化合物X2Y2 | |
| C. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY<XmR | |
| D. | 元素W、R的最高价氧化物的水化物都是强酸 |
分析 X、Y、Z、W、R是5种短周期元素,其原子序数依次增加,X是元素周期表中原子半径最小的元素,则X是H元素;
Y原子最外层电子数是次外层电子数的3倍,则Y原子的L层电子数是6,所以Y是O元素;
Z、W、R处于同一周期,R与Y处于同一族,且都是短周期元素,所以R是S元素,Z在同周期中原子半径最大,则Z是Na元素,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则W是Al元素,然后结合元素周期律及元素化合物知识来解答.
解答 解:X、Y、Z、W、R是5种短周期元素,其原子序数依次增加,X是元素周期表中原子半径最小的元素,则X是H元素;
Y原子最外层电子数是次外层电子数的3倍,则Y原子的L层电子数是6,所以Y是O元素;
Z、W、R处于同一周期,R与Y处于同一族,且都是短周期元素,所以R是S元素,Z在同周期中原子半径最大,则Z是Na元素,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则W是Al元素,
A.元素Y、Z、W具有相同电子层的离子,原子序数大的离子半径小,其半径依次减小,故A错误;
B.元素X能与元素Y形成化合物H2O2,故B正确;
C.非金属性Y>R,分别与元素X形成的化合物的热稳定性:XmY>XmR,故C错误;
D.R的最高价氧化物的水化物为硫酸,硫酸是强酸,而W的最高价氧化物的水化物为氢氧化铝,为两性氢氧化物,故D错误;
故选B.
点评 本题考查原子结构及元素周期律,为高频考点,把握原子结构、元素的性质推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
12.关于某无色溶液中所含离子的鉴别,下列判断正确的是( )
| A. | 加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有Cl-存在 | |
| B. | 加入几滴KSCN溶液,溶液变成红色,可确定有Fe3+存在 | |
| C. | 加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在 | |
| D. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 |
7.物质的提纯是化学实验中的一项重要操作,也是化工生产及物质制备中的主要环节.下列有关叙述中,不正确的是( )
| A. | 油脂的提纯中,可将油脂加入浓NaOH浓液中加热,然后过滤,滤出的溶液即为较纯的油脂 | |
| B. | 在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓(NH4)2SO4溶液,然后将所得沉淀滤出,即得较纯的蛋白质 | |
| C. | 乙酸乙酯中混有乙酸,可选用饱和 Na2CO3溶液洗涤,然后分液 | |
| D. | 甘蔗是制备蔗糖的主要原料,榨出的甘蔗汁因含色素而呈棕黄色,在制取蔗糖前应先加入适量的活性炭,搅拌、过滤、蒸发结晶,即得较纯的蔗糖 |
14.下列气态氢化物中最不稳定的是( )
| A. | PH3 | B. | H2S | C. | HCl | D. | H2O |
11.下列说法正确的是( )
| A. | 自来水出现水质污染物邻叔丁基苯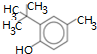 的分子式是C11H16O 的分子式是C11H16O | |
| B. | 有机物CH3CO18OH和C2H5OH在浓硫酸催化作用下产物为CH3CO18OC2H5和H2O | |
| C. | 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 | |
| D. | 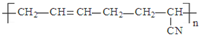 的单体是CH3-C≡C-CH3和CH2=CH-CN 的单体是CH3-C≡C-CH3和CH2=CH-CN |
 ,C和E形成化合物的电子式
,C和E形成化合物的电子式 .
.