题目内容
有关氧化还原反应的叙述正确的是( )
| A、氧化还原反应必然有氧元素的得失 |
| B、置换反应一定属于氧化还原反应 |
| C、某元素在化学反应中由化合态变为游离态,该元素可能被氧化,也可能被还原 |
| D、失电子越多还原性越强,得电子越多氧化性越强 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:氧化还原反应的本质是有电子的转移,即氧化还原反应中一定有元素化合价的变化,在氧化还原反应中得电子的反应物作氧化剂,被还原,失电子的反应物作还原剂,被氧化.
解答:
解:A.只要是有电子转移的反应一定是氧化还原反应,不一定要有氧元素参加,如氯气与氢气的反应,故A错误;
B.置换反应是一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,反应中一定存在化合价的变化,属于氧化还原反应,故B正确;
C.某元素在化学反应中由化合态变为游离态,该元素的化合价可能升高被氧化,也可能降低被还原,故C正确;
D.氧化性与得电子能力有关,得电子能力越强,则氧化性越强,与得电子多少无关,故D错误;
故选BC.
B.置换反应是一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,反应中一定存在化合价的变化,属于氧化还原反应,故B正确;
C.某元素在化学反应中由化合态变为游离态,该元素的化合价可能升高被氧化,也可能降低被还原,故C正确;
D.氧化性与得电子能力有关,得电子能力越强,则氧化性越强,与得电子多少无关,故D错误;
故选BC.
点评:本题考查了氧化还原反应,侧重于氧化还原反应的实质和有关概念的考查,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
除去铜粉中的少量铝粉,可选用( )
| A、水 | B、氯化钠溶液 |
| C、盐酸 | D、氢氧化钠溶液 |
下列反应能用勒夏特列原理解释的是( )
| A、煅烧粉碎的黄铁矿矿石有利于SO2的生成 |
| B、硫酸生产中用98%的硫酸吸收SO3,而不用H2O或稀硫酸吸收SO3 |
| C、加入催化剂有利于氨的合成 |
| D、工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料.点燃时铝粉被氧化,放出热量并引发高氯酸铵反应,其方程式可表示为:2NH4ClO4(s)═N2(g)+4H2O(g)+Cl2(g)+2O2(g)△H<0.
下列对该反应的叙述错误的是( )
下列对该反应的叙述错误的是( )
| A、该反应属于分解反应 |
| B、反应瞬间产生大量高温气体推动航天飞机飞行 |
| C、该反应主要是将化学能转变为热能和动能 |
| D、在反应中高氯酸铵只作氧化剂 |
铅蓄电池在现代生活中有广泛的应用.其电极材料是Pb和PbO2,电解质是稀硫酸.Pb+PbO2+2H2SO4
2PbSO4+2H2O,下列说法正确的是( )
| 放电 |
| 充电 |
| A、铅蓄电池使用一段时间后要添加硫酸 |
| B、电池充电时,阴极反应为:Pb-2e-+SO42-═PbSO4 |
| C、电池充电时,电池正极应和电源的正极相连接 |
| D、电池放电时,电池正极周围溶液pH不断增大 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1molN2所含有的原子数为NA |
| B、标准状况下,22.4L水中含有的水分子数为NA |
| C、标准状况下,22.4L氯化氢所含的原子数为NA |
| D、24gO2分子和24gO3分子所含的氧原子数目相等 |
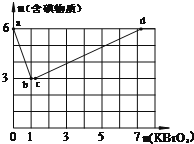 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.