题目内容
 某化学兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液蓝色消失时,立即关闭活塞A.
某化学兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液蓝色消失时,立即关闭活塞A.(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是
(2)洗气瓶C中发生反应的离子方程式
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量
考点:实验装置综合,二氧化硫的化学性质
专题:实验题,元素及其化合物
分析:(1)洗气瓶C中导管末端连接一个多孔球泡D,可以增大SO2与碘水的接触面积,使SO2和碘水充分反应;
(2)C中为二氧化硫与单质碘反应生成硫酸和氢碘酸;
(3)没有及时关闭活塞A,则通过流量计的气体中的二氧化硫不能全部被吸收.
(2)C中为二氧化硫与单质碘反应生成硫酸和氢碘酸;
(3)没有及时关闭活塞A,则通过流量计的气体中的二氧化硫不能全部被吸收.
解答:
解:(1)洗气瓶C中导管末端连接一个多孔球泡D,可以增大SO2与碘水的接触面积,使SO2和碘水充分反应;
故答案为:增大气体与溶液的接触面积,有利于SO2与碘水反应;
(2)C中为二氧化硫与单质碘反应生成硫酸和氢碘酸,硫酸与氢碘酸为强酸,所以其反应的离子方程式为:SO2+I2+2H2O=SO42-+2I-+4H+;
故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
(3)没有及时关闭活塞A,则通过流量计的气体中的二氧化硫不能全部被吸收,所以测得的二氧化硫的量偏小,则二氧化硫的含量偏低;
故答案为:偏低.
故答案为:增大气体与溶液的接触面积,有利于SO2与碘水反应;
(2)C中为二氧化硫与单质碘反应生成硫酸和氢碘酸,硫酸与氢碘酸为强酸,所以其反应的离子方程式为:SO2+I2+2H2O=SO42-+2I-+4H+;
故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
(3)没有及时关闭活塞A,则通过流量计的气体中的二氧化硫不能全部被吸收,所以测得的二氧化硫的量偏小,则二氧化硫的含量偏低;
故答案为:偏低.
点评:本题考查了硫酸工厂排放尾气中二氧化硫的含量的测定,涉及方案评价、离子方程式的书写、误差分析,侧重于基础知识的考查,难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
对下列事实的解释正确的是( )
| A、蔗糖加入浓硫酸后变黑,说明浓硫酸具有吸水性 |
| B、向50mL18mol?L-1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量小于0.45mol |
| C、常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 |
| D、SO2使高锰酸钾溶液褪色,说明SO2具有漂白性 |
下列化学用语表示正确的是( )
A、HClO的电子式为 |
B、硝基苯的结构简式为 |
| C、饱和醇的通式CnH2n+2O |
D、 表示甲烷分子的球棍模型 表示甲烷分子的球棍模型 |
对如图所示分子的叙述不正确的是( )


| A、能发生碱性水解,1mol该有机物完全反应消耗8mol NaOH |
| B、常温下,与Na2CO3溶液反应放出CO2 |
| C、与稀H2SO4共热,生成两种有机物 |
| D、该有机物的分子式为C14H10O9 |
 某研究性学习小组欲探究“在加热条件下FeSO4的分解产物”?
某研究性学习小组欲探究“在加热条件下FeSO4的分解产物”?
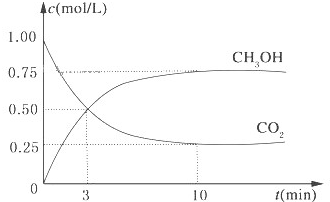 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.

 金属铜广泛地应用于电气、机械制造、国防等领域.
金属铜广泛地应用于电气、机械制造、国防等领域.