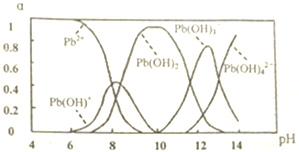
题目内容
16.常温下,下列各组离子一定能大量共存的是( )| A. | Ba2+、Mg2+、SO42-、Cl- | B. | NH4+、Na+、Cl-、OH- | ||
| C. | K+、Na+、SO42-、NO3- | D. | H+、Cl-、HCO3-、SO42- |
分析 A.钡离子与硫酸根离子反应生成硫酸钡沉淀;
B.铵根离子与氢氧根离子反应;
C.四种离子之间不发生反应,能够共存;
D.氢离子与碳酸氢根离子反应生成二氧化碳气体和水.
解答 解:A.Ba2+、SO42-之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故A错误;
B.NH4+、OH-之间反应生成一水合氨,在溶液中不能大量共存,故B错误;
C.K+、Na+、SO42-、NO3-之间不反应,在溶液中能够大量共存,故C正确;
D.H+、HCO3-之间反应生成二氧化碳气体和水,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
6.下列除杂所用的仪器方法,不正确的是( )
| A. | 苯中的甲苯:加溴水分液 | |
| B. | 乙醇中的水:加新制CaO蒸馏 | |
| C. | 甲烷中的乙烯:用溴的四氯化碳溶液洗气 | |
| D. | 乙酸乙酯中的乙酸:加饱和Na2CO3溶液分液 |
7.下列指定反应的离子方程式正确的是( )
| A. | 用食醋除去水垢:${CO}_{3}^{2-}$+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | 用惰性电解电解氯化镁溶液:Mg2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3- | |
| D. | 碳酸氢钠溶液显碱性:${HCO}_{3}^{-}$+H2O?H2CO3+OH- |
4.短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为16.X是元素周期表中原子半径最小的元素,Z与X原子的最外层电子数相同,Y与W同主族.下列说法正确的是( )
| A. | 原子半径:r(Y)>r(Z) | |
| B. | X和Z都只能形成一种氧化物 | |
| C. | W的最高价氧化物对应的水化物是强酸 | |
| D. | Y的简单气态氢化物的热稳定性比W的弱 |
1.下列表示对应化学反应的离子方程式正确的是( )
| A. | 氧化铜与稀硫酸反应:O2-+2H+═H2O | |
| B. | Na投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 铜与浓硝酸的反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 氢氧化钡与稀硫酸的反应:H++2SO42-+2Ba2++OH-═2BaSO4↓+H2O |
8.已知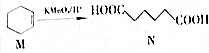 .下列说法错误的是( )
.下列说法错误的是( )
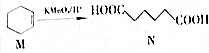 .下列说法错误的是( )
.下列说法错误的是( )| A. | M的分子式为C6H10 | |
| B. | M中所有碳原子在同一平面上 | |
| C. | N能发生氧化反应和取代反应 | |
| D. | N的含有相同官能团的同分异构体有8种(不考虑立体异构) |
5.下列有机物的命名正确的是( )
| A. | CH≡C一CH2CH3 丁炔 | B. | CH2=CH-CH=CH-CH3 1,3-二戊烯 | ||
| C. | 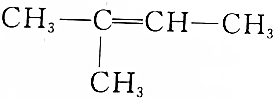 2-甲基丁烯 | D. | 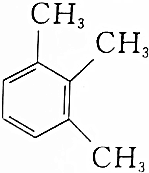 1,2,3-三甲苯 |
6. Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
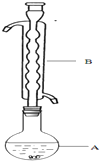
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过加热浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管_.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.
(3)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
则所得产品的纯度为103.2%,你认为影响纯度的主要原因是(不考虑操作引起的误差)含有的Na2SO3也会和I2发生反应,从而影响纯度.
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过加热浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管_.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.
(3)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |